最新Nature:新抗原特异性细胞毒性Tr1 CD4 T细胞可抑制癌症免疫治疗
时间:2024-08-07 23:00:39 热度:37.1℃ 作者:网络
免疫疗法和T细胞
癌症免疫疗法的理想结果是产生能够破坏肿瘤的肿瘤特异性CD8+细胞溶解性T细胞(CTL)。尽管这些效应细胞的诱导通常是由“辅助”CD4+T细胞促进的,但这一过程也可以被CD4+FOXP3+调节性T(Treg)细胞抑制。最近的研究表明,常规Treg细胞可能不是存在于逐渐生长的肿瘤中的唯一免疫抑制CD4+T细胞群,但确定后者的起源、性质和功能一直是一个挑战。这对癌症免疫疗法,特别是癌症特异性新抗原疫苗,提出了理论和实践上的限制。CD4+Tr1细胞维持耐受的能力已在自身免疫和慢性感染中得到很好的确立,并被认为有助于癌症免疫抑制。然而,Tr1细胞尚未根据主转录因子进行定义,而是被鉴定为FOXP3阴性、产生IL-10的抑制性细胞。
发现可抑制免疫疗法的新型T细胞
在这项研究中,华盛顿大学Robert D. Schreiber等人使用特征明确的同基因小鼠肉瘤模型来证明,尽管含有肿瘤特异性MHC-I 新抗原(neoantigen,neoAg)和低输入肿瘤特异性MHC-II neoAg的合成长肽(SLP)neoAg疫苗有效地促进了肿瘤排斥反应,但表达大量相同MHC-II neoAgs的类似疫苗出乎意料地诱导了不同于抑制肿瘤消除的Treg细胞的免疫抑制性CD4+T细胞。作者将这些细胞描述为溶细胞性Tr1细胞,深入了解它们的发育和作用机制,并验证规避其抑制活性的策略。研究进一步表明,在小鼠逐渐生长的肿瘤中,当它们对抗PD1疗法不敏感时,以及在对免疫检查点疗法(ICT)和癌症疫苗反应较差的癌症患者中,可以发现类似的CD4+T细胞群。研究还证明,消除这些细胞或抑制其功能可使癌症免疫疗法更有效。因此,这项研究不仅记录了已知CD4+T细胞亚群的新功能,还提供了一种规避其对肿瘤排斥反应抑制作用的策略。相关工作以“Neoantigen-specific cytotoxic Tr1 CD4 T cells suppress cancer immunotherapy”为题发表在Nature。
【文章要点】
使用含有MHC I类(MHC-I)新抗原(neoAg)和不同剂量的肿瘤衍生MHC-II neoAg的疫苗,作者发现,虽然包含低剂量MHC II限制性肽(LDVax)的疫苗促进了肿瘤排斥反应,但含有高剂量相同MHC-II新抗原(HDVax)疫苗抑制了排斥反应。HDVax诱导的抑制性细胞的特征鉴定为表达IL-10、颗粒酶B、穿孔素、CCL5和LILRB4的1型调节性T(Tr1)细胞。该研究表明HDVax对抗肿瘤疗效的抑制是由于诱导了细胞溶解性肿瘤抗原特异性Tr1细胞,这些细胞可在体外和体内杀死了MHC-II肿瘤抗原呈递型1型常规树突状细胞(cDC1s)。因此,本工作确定了已知CD4+T细胞亚群的关键抑制功能。此外,作者还证明,当Tr1细胞对抗-PD1产生耐药性时,Tr1细胞在进行性生长的肿瘤中可被检测到,这有力地证明了HDVax诱导的细胞是那些在进行性肿瘤生长过程中出现的细胞的直系同源物。
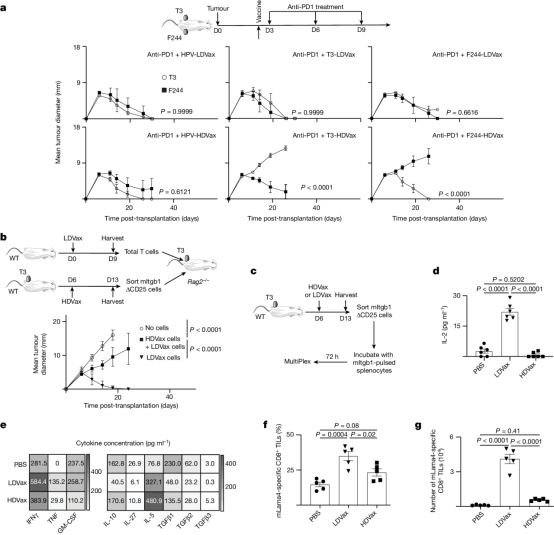
图1 抑制HDVax对于肿瘤的MHC-II neoAg来说是特异性的
肿瘤特异性Tr1细胞抑制了由抗PD1、LDVax或过继转移的肿瘤特异性效应T细胞诱导的肿瘤排斥反应。从机制上讲,HDVax诱导的Tr1细胞选择性地杀死cDC1s,导致肿瘤中cDC1s数量变低。研究还表明,Tr1细胞上的表型标记因其分离的解剖部位而异。因此,尽管HDVax诱导的脾脏中Tr1样细胞通过CD49b和LAG3的表达进行了差异标记,但TIL中的细胞缺乏这些标记物的差异表达,但仍然保留了产生IL-10的能力,IL-10是Tr1细胞的标志性细胞因子。相比之下,LILRB4表达清楚地识别了脾脏和肿瘤微环境中的小鼠Tr1样细胞。作者还意识到,HDVax诱导的抑制性Tr1细胞和LDVax效应物诱导的辅助CD4+T细胞表达相似水平的CD39,这表明需要CD39以外的其他因素来区分抑制和促进肿瘤排斥的CD4+T细胞(图2)。
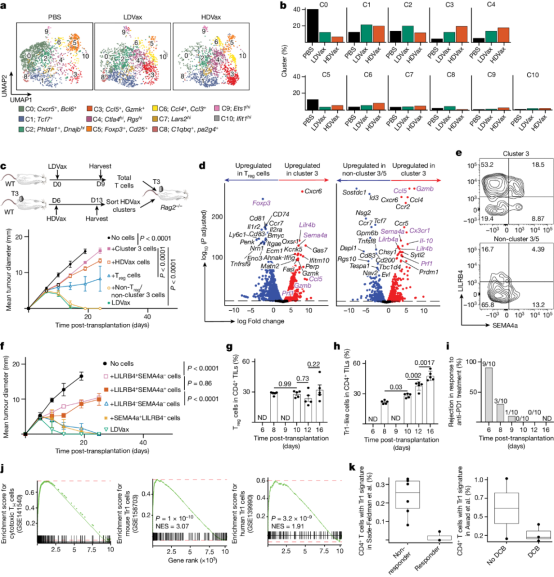
图2 HDVax诱导的细胞是细胞毒性的Tr1细胞
最后,作者还提出了克服这种抑制的方法,特别是通过抗LILRB4阻断、使用CD8导向的IL-2突变蛋白或靶向缺失cDC2/单核细胞。总之,这些数据表明,维持外周耐受性的细胞毒性Tr1细胞也可抑制抗肿瘤反应,从而起到阻碍癌症免疫控制的作用(图3)。
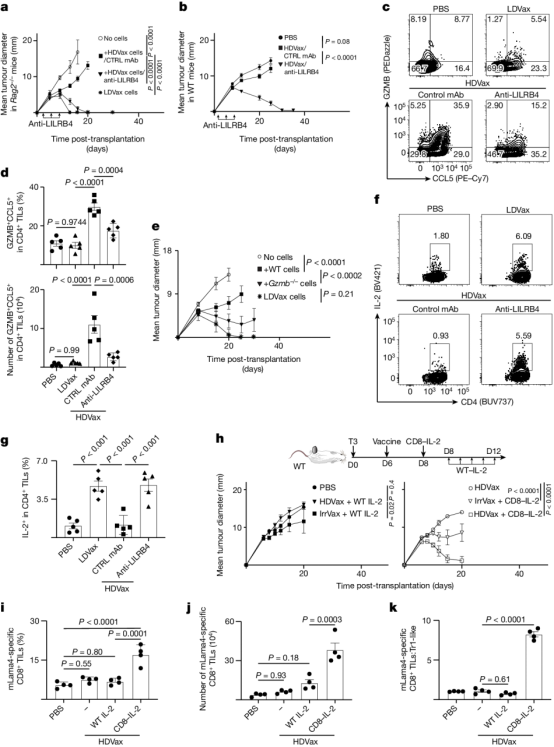
图3 抗LILRB4治疗可逆转HDVax诱导GZMB/CCL5和抑制IL-2的产生
【结论与展望】
上述研究提出了这样一种可能性,即任何MHC-II neoAg在以高水平产生或释放时都可能是类抑制素的,从而拓宽了抑制素的定义。因此,未来的研究还必须探索Tr1细胞的诱导是否取决于所使用的疫苗平台的类型(例如,基于肽的疫苗、基于DNA的疫苗和基于RNA的疫苗)。总的来说,本文鉴定了Tr1细胞及其在癌症中的免疫抑制生物学功能,并提供策略来规避其抑制功能,为提高癌症免疫疗法的总体有效性提供了潜在的新靶点。
原文链接:
https://www.nature.com/articles/s41586-024-07752-y


