沈银忠教授:HIV患者感染相关肝损害的识别与处理
时间:2024-08-13 14:00:53 热度:37.1℃ 作者:网络
随着抗逆转录病毒治疗(ART)方案的不断更新及普及,艾滋病患者的生存质量和预后得到了显著改善。人类免疫缺陷病毒(HIV)对肝细胞有直接损伤作用,同时HIV治疗药物、代谢相关并发症、酗酒等多种因素也可引起肝脏损伤。此外,由于免疫功能抑制,HIV患者发生其他病毒、细菌、真菌等病原体感染的风险较普通人群明显增加,且容易造成播散性感染,进而影响或累及肝脏。因此,HIV患者感染相关肝损害已成为临床医生需要关注的热点。
上海市公共卫生临床中心沈银忠教授曾分享“HIV患者感染相关肝损害的识别与处理”,感染前沿特将精华整理成文,以飨读者。
2022年7月世界卫生组织发布的全球HIV疫情报告显示,截至2021年底全球HIV感染者3840万,2021年新发HIV感染者150万,2021年HIV相关死亡达65万。可见,HIV感染仍是威胁人类健康的重要公共卫生问题之一。如何降低HIV新发感染及HIV相关死亡仍是我们努力的方向。
HIV感染导致机体免疫缺陷,引起各种机会性感染和肿瘤的发生,同时导致异常的免疫激活,促进慢性活动性并发症的发生。因此,在HIV感染期间,减少免疫缺陷及异常免疫激活,对改善患者预后至关重要。
HIV感染的疾病病程可分三期,即急性期、无症状期和艾滋病期。
急性期:通常发生在感染HIV后的6个月内。部分感染者在急性期出现HIV病毒血症和免疫系统急性损伤相关临床表现。临床表现以发热最为常见,可伴有咽痛、盗汗、恶心、呕吐、腹泻、皮疹、关节疼痛、淋巴结肿大及神经系统症状。大多数患者临床症状轻微,持续1~3周后自行缓解。此期在血液中可检测到HIV RNA和p24抗原,CD4+T淋巴细胞计数一过性减少,CD4+/CD8+T淋巴细胞比值倒置。部分患者可有轻度白细胞和血小板计数减少或肝脏生化指标异常。
无症状期:可从急性期进入此期,或无明显的急性期症状而直接进入此期。持续时间一般为4~8年。其时间长短与感染病毒的数量和型别、感染途径、机体免疫状况的个体差异、营养条件及生活习惯等因素有关。在无症状期,由于HIV在感染者体内不断复制,免疫系统受损,CD4+T淋巴细胞计数逐渐下降,可出现淋巴结肿大等症状或体征。
艾滋病期:为感染HIV后的终末阶段。患者CD4+T淋巴细胞计数多<200/μL。此期主要临床表现为HIV相关症状、体征及各种机会性感染和肿瘤。
临床上,患者的免疫状态可分为轻度、中度、高度免疫抑制。随着免疫抑制程度的增加,患者发生感染和肿瘤的风险上升,而这些感染往往在普通人群发病率较低。艾滋病期可以发生各种各样的感染,如反复发生的细菌感染、肝脏感染、真菌及寄生虫感染、病毒感染、肿瘤等。有研究显示,HIV患者住院的常见原因是细菌感染、肺孢子菌肺炎(PCP)共感染,其次是结核病、隐球菌病、淋巴瘤、巨细胞病毒感染和马尔尼菲篮状菌病[1]。HIV患者免疫功能低下,很容易出现血流感染,其常见的病原体包括隐球菌、马尔尼菲篮状菌、非结核分枝杆菌(MAC)、结核杆菌[2]。这些病原体均可造成血流播散性感染,造成机体肝功能损伤。
转氨酶可以反映肝损伤的变化情况,有研究显示HIV患者中转氨酶升高的发生率高达32%,可见三分一以上的患者可能存在肝功能异常[3]。我国广西一项长达11年的回顾性队列研究显示,基线肝功能正常的艾滋病患者在抗病毒早期出现肝功能异常,且比例偏高,但随着治疗时间的延长,肝功能异常的比例降低并趋于稳定。因此,未合并肝损伤的艾滋病患者在抗病毒治疗后可出现肝功能异常,但不能完全归因于抗病毒治疗,应考虑其他肝损伤的原因[4]。
上海市公共卫生临床中心的一项研究分析了HIV感染住院患者死亡的原因。其中艾滋病相关的死亡包括肺孢子菌肺炎、活动性结核病或非结核分枝杆菌病、及肿瘤等;非艾滋病相关的死亡包括脓毒症、肝脏疾病及其他疾病等,其中肝脏疾病占3.6%,可见肝脏疾病是导致HIV患者住院、死亡的原因之一。
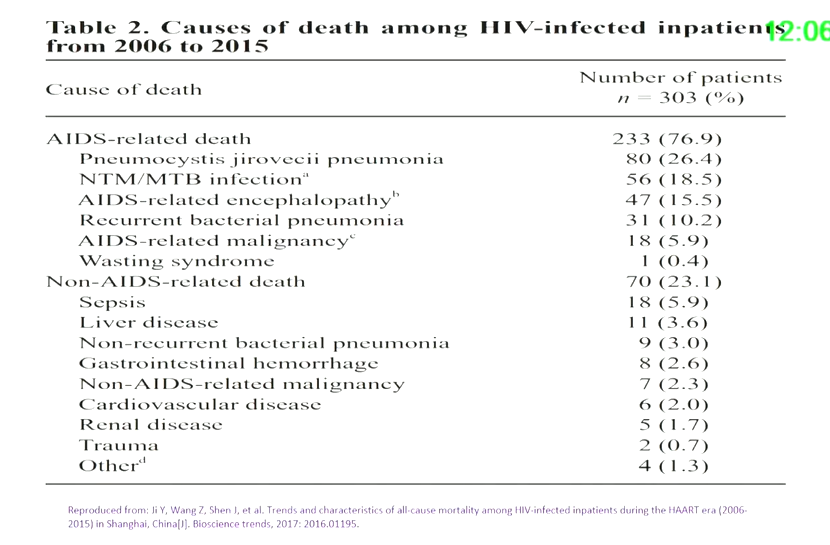
因此,艾滋病的重要诊疗理念是HIV/AIDS的全病程管理,需要关注非艾滋病相关疾病的诊断和治疗。
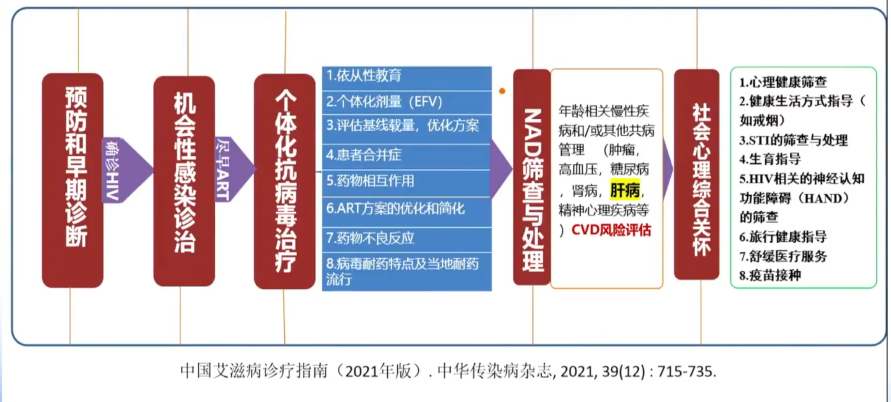
首先,我们需要了解HIV患者肝损害的病因,主要包括以下几个方面:
HIV感染者发生肝损害的原因包括乙肝和丙肝病毒的合并感染、酗酒、抗逆转录病毒治疗引起的肝毒性、HIV本身以及导致非酒精性脂肪肝的常见代谢合并症等
1.HIV感染
2.病毒性肝炎(HAV、HBV、HCV、CMV)
有研究显示,11-14%和10%的HIV感染者分别同时感染HCV和HBV。
3.机会感染相关性肝损害(细菌、真菌、病毒、寄生虫、MTB、NTM)
4.药物性肝损害(ART、抗结核药、抗真菌药、抗肿瘤药、中药)
5.自身免疫性肝病
6.酒精性肝损害
7.代谢相关性脂肪性肝病
8.其他(肝脏占位、中毒、肝内外胆道梗阻等)
HIV感染者不同肝病中ALT和AST的典型升高模式,如下图:
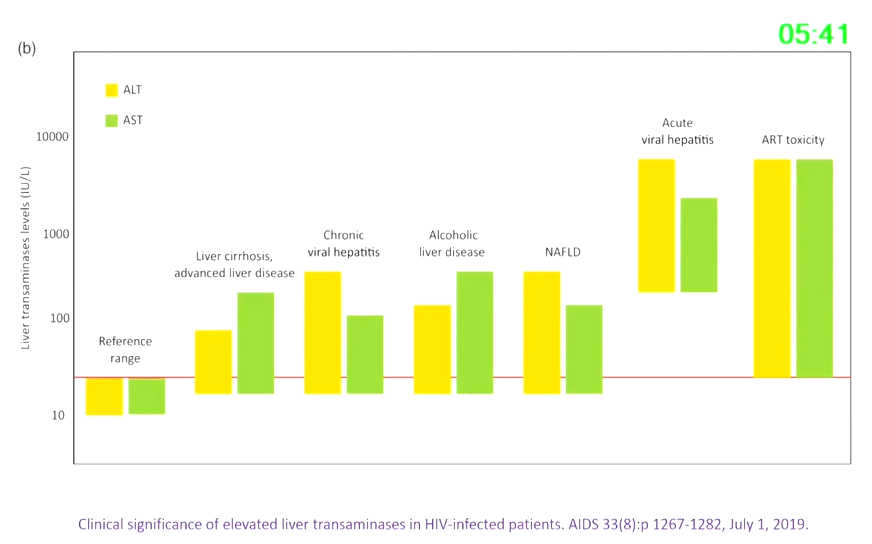
其次,我们需要了解HIV相关肝损害的机制及与HBV/HCV合并感染的相互影响。
HIV直接作用于肝细胞和非实质细胞(如Kupffer细胞等免疫细胞)诱导肝损伤,这些细胞经感染后,与未感染的细胞相互作用,导致肝损伤的扩散;导致HIV感染者发生肝脏炎症和纤维化的机制很多,以HIV对肝细胞的促凋亡作用和HIV相关的微生物移位最为重要;二次打击可大幅加剧HIV对肝细胞的损伤,以酒精最重要。对HIV感染者的管理需要及时发现其肝损伤状况,以有针对性地诊治[5]。

最后,由于免疫功能抑制,HIV患者可出现各种细菌、真菌感染。
HIV相关细菌感染主要包括普通细菌感染、结核/非结核分枝杆菌感染(MAC),临床上需要关注的是MAC。在缺乏有效的抗逆转录病毒治疗或化学预防治疗的严重免疫抑制HIV患者中,MAC的发生率为20%至40%。随着抗逆转录病毒治疗的普及,患者免疫功能不断重建,出现MAC感染的比例有所下降。临床上,MAC除了引起肺部疾病外,通常是一种播散性多器官感染,表现为发烧、盗汗、体重减轻、疲劳、腹泻和腹痛,出现贫血、ALP升高、肝脾肿大或淋巴结病变。该病主要通过在临床症状、体征基础上,结合血液、淋巴结、骨髓以及其他无菌组织或体液中培养出MAC来确诊。在呼吸道或胃肠道中检测到MAC可能代表这些部位的定植,可能是播散性MAC感染的先兆。因此,临床高度怀疑MAC感染时,需采取标本进行涂片和培养,进行菌种的鉴定及精准治疗[6]。

HIV患者临床上常见的真菌感染主要包括新型隐球菌、组织胞浆菌、肺孢子菌、马尔尼菲篮状菌、曲霉菌等,其中,隐球菌和马尔尼菲蓝状菌占比较高。马尔尼菲蓝状菌主要分布在东南亚及我国南方地区[7,8],近年来HIV合并马尔尼菲蓝状菌病的发病率逐年上升[9]。该病在临床上引起全身播散性感染,累及多个系统,皮肤、黏膜受到累及的可能性大,可以影响到消化系统,出现肝功能异常,有研究显示8%的患者出现黄疸,51%出现肝脏肿大[10]。

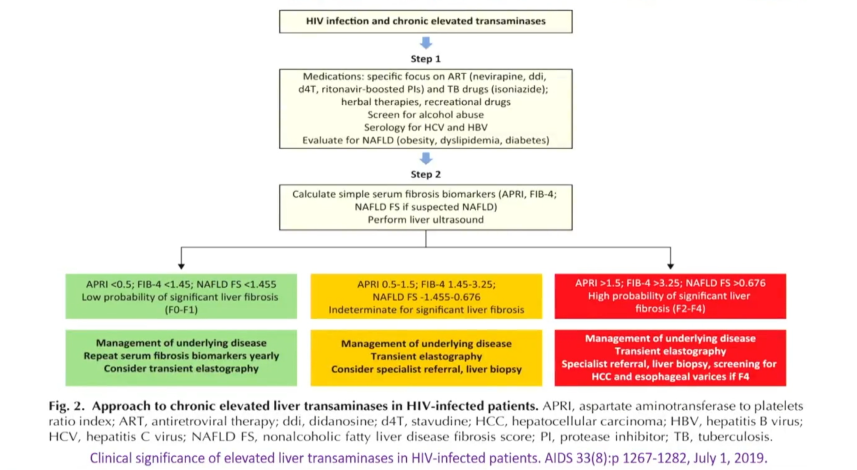
HIV患者慢性转氨酶升高的处理路径,如下图:
总结
HIV患者肝损害的原因复杂多样,其中各种感染是常见原因。HIV本身导致的肝损害需要引起重视。合并乙肝、丙肝感染促进疾病进展,HIV患者建议常规筛查HCV和HBV感染;机会感染包括细菌、真菌、病毒、结核杆菌、非结核分枝杆菌是常见原因。处理措施包括尽可能明确病因,排除非感染因素,针对各种感染给予相应的治疗,并尽早启动抗病毒治疗。
参考文献
1.Luo B, Sun J, Cai R, et al. Spectrum of Opportunistic Infections and Risk Factors for In-Hospital Mortality of Admitted AIDS Patients in Shanghai. Medicine (Baltimore). 2016;95(21):e3802.
2.Qi T, Zhang R, Shen Y, et al. Etiology and clinical features of 229 cases of bloodstream infection among Chinese HIV/AIDS patients: a retrospective cross-pal study. Eur J Clin Microbiol Infect Dis. 2016;35(11):1767-1770.
3.Cai J, Osikowicz M, Sebastiani G. Clinical significance of elevated liver transaminases in HIV-infected patients. AIDS. 2019;33(8):1267-1282.
4.Qin F, Jiang J, Qin C, et al. Liver damage in patients living with HIV on antiretroviral treatment with normal baseline liver function and without HBV/HCV infection: an 11-year retrospective cohort study in Guangxi, China. BMJ Open. 2019;9(4):e023140.
5.Ganesan M, Poluektova LY, Kharbanda KK, Osna NA. Liver as a target of human immunodeficiency virus infection. World J Gastroenterol. 2018 Nov 14;24(42):4728-4737.
6.Guidelines for the prevention and treatment of opportunistic infections in adults and adolescents with HIV, Updated: June 9, 2022.
7.Narayanasamy S, Dat VQ, Thanh NT, et al. A global call for talaromycosis to be recognised as a neglected tropical disease. Lancet Glob Health. 2021;9(11):e1618-e1622.
8.Li Z, Li Y, Chen Y, et al. Trends of pulmonary fungal infections from 2013 to 2019: an AI-based real-world observational study in Guangzhou, China. Emerg Microbes Infect. 2021;10(1):450-460.
9.Ying RS, Le T, Cai WP, et al. Clinical epidemiology and outcome of HIV-associated talaromycosis in Guangdong, China, during 2011-2017. HIV Med. 2020;21(11):729-738.
10.Ustianowski AP, Sieu TP, Day JN. Penicillium marneffei infection in HIV. Curr Opin Infect Dis. 2008;21(1):31-36.


