Nat Commun 南京鼓楼医院王敏、周敏/耶鲁大学周焕娇团队揭示SRF SUMO化在平滑肌细胞表型转换和血管重塑中的调控机制
时间:2024-08-14 17:00:14 热度:37.1℃ 作者:网络
心血管疾病(CVD)是全球范围内导致死亡和残疾的主要原因之一,其发病机制复杂多样。血管平滑肌细胞(VSMCs)在维持血管结构和功能中扮演着至关重要的角色。VSMCs的表型转换—从收缩型向合成型转变,是心血管疾病发生发展的关键过程。血清反应因子(Serum Response Factor, SRF)是一种关键的转录因子,控制着血管平滑肌细胞(VSMCs)的基因表达。尽管已有诸多研究探索了SRF在VSMC表型转换中的重要作用,但其活性如何受到翻译后修饰(如SUMO化)的调控以及在心血管疾病中的作用机制仍不清楚。
2024年8月13日,南京大学医学院附属鼓楼医院王敏教授、周敏教授团队联合耶鲁大学血管中心周焕娇教授团队在Nature Communications发表题为“SRF SUMOylation modulates smooth muscle phenotypic switch and vascular remodeling”的研究论文。该论文探讨了SENP1蛋白(一种SUMO特异性蛋白酶)在VSMCs中的缺失对SRF SUMO化的影响,揭示了其在VSMCs表型转换过程中的关键作用。本研究不仅有助于深入理解血管损伤后发生病理性重塑的分子机制,还为心血管疾病治疗开发新的分子靶点提供了理论依据。

首先,该研究利用VSMCs特异性敲除SENP1的基因工程化小鼠进行研究,在颈动脉导丝损伤造模后的第28天,SENP1缺失小鼠的新生内膜面积显著增加。研究者利用转录组测序分析发现,SENP1缺失显著促进了VSMC的增殖和迁移,具体表现为增殖标志物(如Cyclin D1和PCNA)表达上调,以及基质金属蛋白酶(MMPs)活性增强,推动了新生内膜的形成。同时,收缩型标记物(如CNN1、α-SMA、SM22α和MYH11)表达下调,而合成型标记物(如MYH10和OPN)表达上调(图1)。这种表型转换在血管损伤后尤为明显,表明了SENP1在维持VSMC收缩表型中的关键作用。
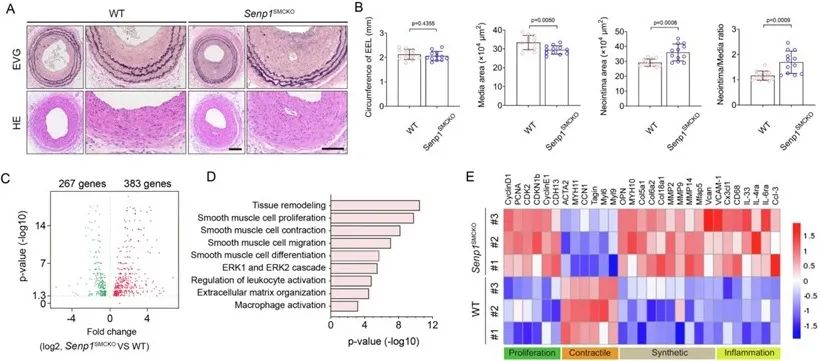
图1. 特异性SENP1缺失导致VSMC增殖、合成表型增强和炎症相关基因激活
研究者进一步探究SENP1对VSMC表型调控机制发现,SENP1缺失导致SRF在143位赖氨酸残基上的SUMO化水平增加,这种修饰减少了SRF在溶酶体中的定位,增加了其在细胞核中的积累。同时,SUMO化的SRF从与心肌素(Myocardin)的复合体转换为与ELK1的复合体,后者促进了VSMCs的合成表型,并促进了血管重塑和新生内膜形成(图2)。
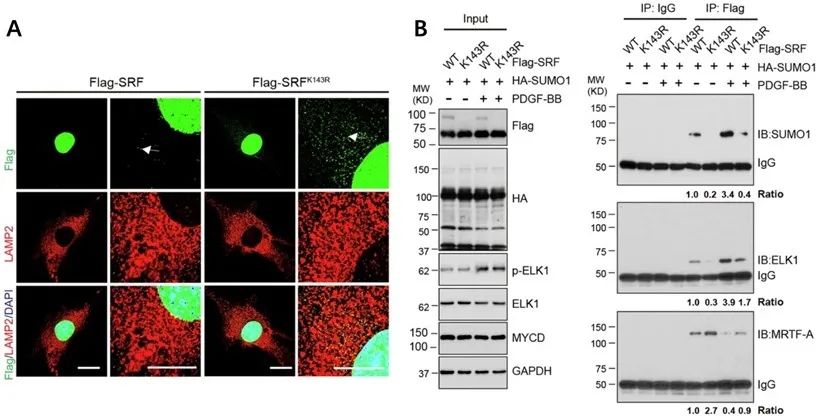
图2. SENP1缺失介导SRF SUMO化水平增加、胞内定位改变、SRF-ELK1复合物形成
为了进一步验证这一机制,研究者使用了ELK1抑制剂AZD6244,结果显示该抑制剂能够阻止SRF-Myocardin复合体向SRF-ELK1复合体的转换,从而减轻了SENP1缺失小鼠中VSMCs的合成表型和新内膜形成(图3)。这一结果表明了靶向SRF复合体在血管病理性重塑疾病中的潜力,为开发针对心血管疾病的新型治疗药物提供了有力支持。
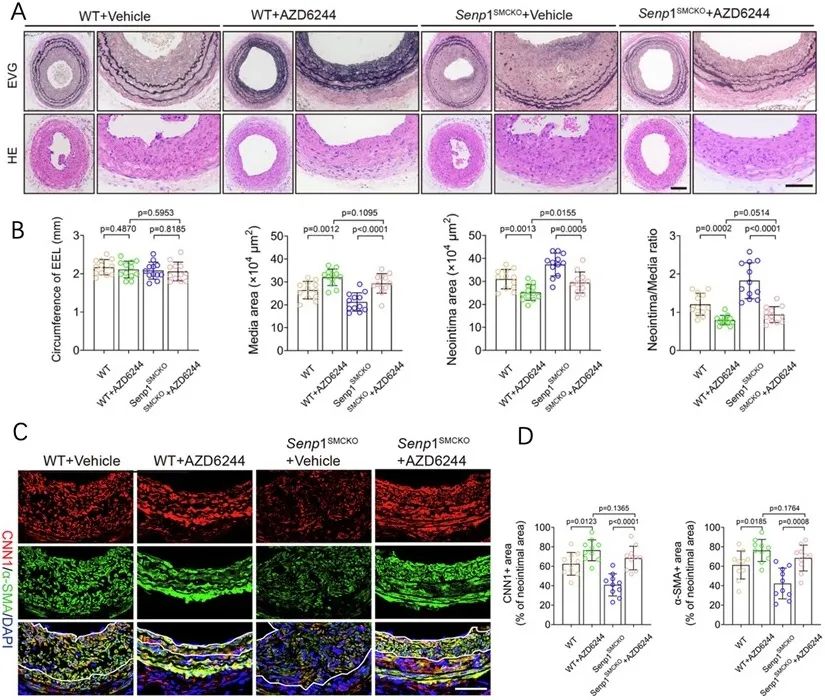
图3. 阻断SRF-ELK1复合体形成可维持VSMC表型并改善血管病理性重塑
综上,本研究首次揭示了SENP1在VSMCs中通过调控SRF SUMO化、SRF-ELK1复合物的形成,进而影响VSMC表型转换和血管重塑的新机制(图4)。这一发现不仅增进了我们对心血管疾病发病机制的理解,还为开发新的治疗策略提供了有力的支持。通过靶向SRF复合物,尤其是抑制SRF-ELK1复合物的形成,可能成为治疗心血管疾病的一种新途径。
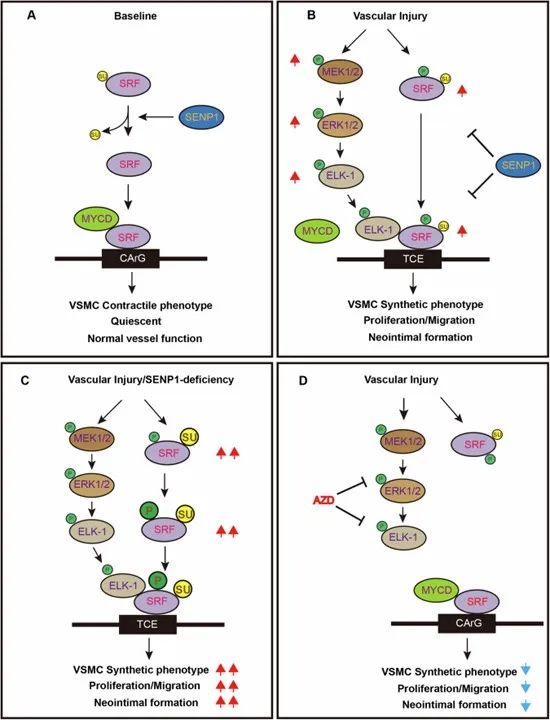
图4. VSMCs中SENP1调控SRF SUMO化及SRF-ELK1复合物的形成机制图
原文链接:
https://www.nature.com/articles/s41467-024-51350-5


