【论著】异钩藤碱对急性脑梗死大鼠认知障碍的影响及机制研究
时间:2024-08-18 06:01:15 热度:37.1℃ 作者:网络
摘要:目的探讨异钩藤碱对急性脑梗死大鼠认知障碍的影响及相应机制。方法将144只SD大鼠按照随机数字表法随机分为假手术组、急性脑梗死组、异钩藤碱低剂量组、异钩藤碱高剂量组、尼莫地平组、异钩藤碱高剂量+干扰素基因刺激蛋白(STING)激动剂(ADU-S100)组,每组24只。除假手术组外,其他各组大鼠均采用线栓闭塞大脑中动脉法构建急性脑梗死大鼠模型,假手术组仅游离右侧颈外动脉、颈总动脉和颈内动脉,不做插入线栓处理。建模成功后立即给药,异钩藤碱低剂量组和异钩藤碱高剂量组大鼠分别灌胃5mg/kg、20mg/kg异钩藤碱,且均需腹腔注射等量的等渗盐水;尼莫地平组大鼠需灌胃30mg/kg尼莫地平,且还需腹腔注射等量的等渗盐水;异钩藤碱高剂量+ADU-S100组大鼠需灌胃20mg/kg异钩藤碱且腹腔注射20mg/kgADU-S100;假手术组、急性脑梗死组大鼠均需灌胃10ml/kg与腹腔注射10ml/kg的等渗盐水。给药1次/d,持续2周。末次给药处理24h后,采用Zela-Longa法对所有大鼠进行神经功能评分,并进行Morris水迷宫实验,记录大鼠的逃避潜伏期及原平台象限停留次数。采用酶联免疫吸附试验(ELISA)检测大鼠血清中白细胞介素(IL)-6、肿瘤坏死因子(TNF)-α水平;检测各组大鼠脑组织含水量;采用2,3,5-三苯基四唑氯化物(TTC)染色测定各组大鼠脑梗死体积;采用伊文思蓝检测各组大鼠血-脑屏障通透性;采用实时定量聚合酶链反应(qRT-PCR)检测大鼠脑组织中闭锁小带蛋白1(ZO-1)、闭合蛋白(occludin)信使核糖核酸(mRNA)表达;采用免疫印迹检测大鼠脑组织中STING、磷酸化TANK结合激酶1(p-TBK1)、磷酸化干扰素调节因子3(p-IRF3)蛋白表达,并进行组间比较。结果(1)与假手术组相比,急性脑梗死组末次给药处理24h后神经功能评分[(2.96±0.32)分比0分]、脑组织含水量[(86.9±3.2)%比(71.8±3.1)%]、血清TNF-α[(86.7±3.5)ng/L比(35.6±1.7) ng/L]、IL-6[(167.8±6.1)ng/L比(50.2 ± 2.2)ng/L]、脑梗死体积[(28.6 ± 1.3)mm3比0mm3]、脑组织中伊文思蓝含量[(1.57±0.13)g/L比(0.96±0.08)g/L]及STING[(1.83±0.16)比(0.86±0.08)]、p-TBK1[(0.89±0.07)比(0.41±0.03)]、p-IRF3[(0.67±0.05)比(0.13±0.01)]蛋白表达均升高,脑组织中ZO-1mRNA[(0.45±0.04)比(1.00±0.00)]、occludin mRNA[(0.23 ± 0.02)比(1.00 ± 0.00)]表达均降低,逃避潜伏期延长[(33.6±1.6)s比(12.3±0.5)s],原平台象限停留次数减少[(5.9±0.2)次比(15.7±0.4)次],组间差异均有统计学意义(均P<0.05)。(2)与急性脑梗死组比较,异钩藤碱低剂量组、异钩藤碱高剂量组、尼莫地平组大鼠末次给药处理24h后神经功能评分[(2.37±0.21)、(1.14±0.17)、(1.18±0.13)分比(2.96±0.32)分]、脑组织含水量[(81.8 ± 3.0)%、(74.9 ± 3.0)%、(74.3±2.9)%比(86.9±3.2)%]、血清TNF-α[(71.1 ± 1.4)、(43.4 ± 2.0)、(41.5±1.9)ng/L比(86.7±3.5)ng/L]、IL-6[(129.8 ± 5.4)、(81.2±3.8)、(80.0±3.6)ng/L比(167.8±6.1)ng/L]、脑梗死体积[(21.7±1.0)、(10.5±0.5)、(10.7±0.5)mm3比(28.6±1.3)mm3]、脑组织中伊文思蓝含量[(1.39±0.12)、(1.16±0.10)、(1.18 ± 0.19)g/L比(1.57 ± 0.13)g/L]及STING [(1.50 ± 0.14)、(1.02 ± 0.11)、(1.01 ± 0.09)比(1.83 ± 0.16)]、p-TBK1 [(0.75 ± 0.05)、(0.54 ± 0.04)、(0.52 ± 0.05)比(0.89 ± 0.07)]、p-IRF3 [(0.51 ± 0.05)、(0.25 ± 0.02)、(0.27 ± 0.02)比(0.67 ± 0.05)]蛋白表达均降低,脑组织中ZO-1mRNA [(0.58 ± 0.05)、(0.87 ± 0.07)、(0.89 ± 0.09)比(0.45±0.04)]、occludin mRNA[(0.36 ± 0.03)、(0.71 ± 0.06)、(0.69 ± 0.05)比(0.23 ± 0.02)]表达均升高,逃避潜伏期缩短[(28.6 ± 1.0)、(16.5 ± 0.7)、(16.4 ± 0.7)s比(33.6 ± 1.6)s],原平台象限停留次数增加[(8.2±0.3)、(12.8±0.5)、(12.9±0.5)次比(5.9±0.2)次],组间差异均有统计学意义(均P<0.05)。(3)与异钩藤碱高剂量组比较,异钩藤碱高剂量+ADU-S100组末次给药处理24h后神经功能评分[(2.12±0.14)分比(1.14±0.17)分]、脑组织含水量[(78.7±3.2)%比(74.9±3.0)%]、血清TNF-α[(59.7±2.1)ng/L比(43.4 ± 2.0)ng/L]、IL-6[(118.9 ± 4.6)ng/L比(81.2 ± 3.8)ng/L]、脑梗死体积[(16.6 ± 0.4)mm3比(10.5 ± 0.5)mm3]、脑组织中伊文思蓝含量[(1.36 ± 0.10)g/L比(1.16 ± 0.10)g/L]及STING[(1.37 ± 0.12)比(1.02 ± 0.11)]、p-TBK1 [(0.67 ± 0.05)比(0.54 ± 0.04)]、p-IRF3 [(0.39 ± 0.03)比(0.25 ± 0.02)]蛋白表达均升高,脑组织中ZO-1mRNA [(0.63 ± 0.05)比(0.87 ± 0.07)]、occludin mRNA [(0.46 ± 0.05)比(0.71 ± 0.06)]表达均降低,逃避潜伏期延长[(23.4 ± 1.0)s比(16.5 ± 0.7)s],原平台象限停留次数减少[(9.6 ± 0.3)次比(12.8 ± 0.5)次],组间差异均有统计学意义(均P<0.05)。结论异钩藤碱可抑制急性脑梗死大鼠炎症、减少血-脑屏障损伤、降低脑水肿程度,改善认知障碍,其机制可能与抑制STING/TBK1/IRF3通路有关。
急性脑梗死是最常见的急性脑血管疾病,其主要由动脉血栓形成导致,该过程可导致血管闭塞和大脑缺氧,进而引起复杂的病理生理反应。急性脑梗死后认知障碍是急性脑梗死患者的主要残疾之一,其可损害患者执行日常生活活动的能力。此外,有研究显示,高达25%的脑梗死后认知障碍患者在脑梗死后3年内确诊为痴呆。因此,开发药物改善患者急性脑梗死后的认知障碍意义重大。异钩藤碱是一种从茜草科植物钩藤中分离出来的生物碱,在脑部疾病中具有抗炎和抗氧化等活性。已有研究报道,异钩藤碱可通过上调miR-122-5p表达,减轻柠檬酸铁铵诱导的HT-22细胞氧化应激和铁死亡,改善脑出血小鼠神经功能,但关于异钩藤碱对急性脑梗死大鼠认知障碍的影响鲜有报道。研究显示,干扰素基因刺激蛋白(stimulator of interferon genes, STING)/TANK结合激酶1(TANK-binding kinase1, TBK1)/干扰素调节因子3(interferon regulatory factor3, IRF3)通路的阻断可改善血管性痴呆大鼠认知障碍。但异钩藤碱是否可通过调控STING/TBK1/IRF3信号通路影响急性脑梗死大鼠认知障碍尚不清楚。基于此,本实验拟通过构建急性脑梗死大鼠模型,探究异钩藤碱对急性脑梗死大鼠认知障碍的影响以及相应的机制。
1 材料
1.1 实验动物
无特定病原体(specific pathogen free, SPF)级雄性SD大鼠144只,体质量为260~270g,平均体质量(266±4)g,由河南省实验动物中心提供[生产许可证号:SCXK(豫)2022-0001]。本实验获牡丹江医学院附属红旗医院伦理委员会批准(伦理编号:20220127)。大鼠饲养在温度为20~25℃,湿度为50%~60%,12h光暗循环的动物房中,可自由饮食与摄水。
1.2 实验药品、试剂
异钩藤碱(批号6859-01-4,上海一基生物试剂有限公司);2,3,5-三苯基四唑氯化物(2,3,5 - triphenyltetrazolium chloride,TTC)染色液(批号20221226,贝博生物公司);尼莫地平(批号20221127,亚宝药业集团股份有限公司);STING激动剂ADU-S100(批号HY-12885,美国MCE公司);大鼠肿瘤坏死因子α(TNF-α)、白细胞介素(IL)-6酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)试剂盒(批号SBJ-R0040、SBJ-R0436,南京森贝伽生物公司);磷酸盐缓冲液(批号20230501,赛默飞世尔科技公司),伊文思蓝(批号20221005,上海如吉生物科技发展有限公司);三氯乙酸(批号20211229,成都博瑞特化学技术有限公司);Trizol试剂(批号R0016,碧云天生物技术有限公司);放射免疫沉淀测定(radio immuno precipitation assay, RIPA)缓冲液(批号MT0066,北京百奥莱博科技有限公司);脱脂牛奶(批号20221018,伊利乳业集团股份有限公司);兔源一抗STING、磷酸化TANK1(phosphorylated TANK-1, p-TBK1)、磷酸化干扰素调节因子3(phospho-IRF3,p-IRF3)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、TBK1、IRF3及羊抗兔二抗(批号ab288157、ab186469、ab138449、ab8245、ab40676、ab238521、ab6721,英国Abcam公司);增强化学发光(enhanced chemiluminescence, ECL)试剂(批号20221001,艾美捷科技有限公司);GDS8000凝胶成像系统(美国UVP公司)。
1.3 仪器
FC酶标仪、NanoDrop分光光度计(赛默飞世尔科技有限公司);PX4202ZH型电子天平(陕西环宇仪器设备有限公司);GF-4BS型烘干箱(泰州市新奇能烘干设备有限公司);Q5荧光定量聚合酶链反应(polymerase chain reaction,PCR)仪(美国ABI公司);DYCP-31DN蛋白电泳仪(北京六一仪器厂)。
2 方法
2.1 急性脑梗死大鼠模型构建及实验动物分组
急性脑梗死大鼠模型构建:采用线栓闭塞大脑中动脉法构建急性脑梗死大鼠模型。取120只SD大鼠,麻醉并仰卧位固定大鼠,切开颈部皮肤,游离大鼠右侧颈外动脉、颈总动脉以及颈内动脉,结扎颈外动脉远心端,并夹闭颈内动脉远心端以及颈总动脉近心端,在颈外动脉处(距离分叉处2mm)作一切口,向切口插入圆头线栓,圆头线栓沿颈内动脉前进至其圆头端距离分叉处约16mm为止,2h后取出线栓,恢复供血,缝合切口,术后24h进行Zea-Longa评分,若评分为1~3分则为造模成功。将建模成功的120只SD大鼠按照随机数字表法分为急性脑梗死组、异钩藤碱低剂量组、异钩藤碱高剂量组、尼莫地平组、异钩藤碱高剂量+STING激动剂(ADU-S100)组,每组24只。另取24只大鼠按上述方法仅游离右侧颈外动脉、颈总动脉和颈内动脉,不做插入线栓处理,作为假手术组。
2.2 实验动物给药
建模成功后立即给药,异钩藤碱低剂量组和异钩藤碱高剂量组大鼠分别灌胃5mg/kg、20mg/kg异钩藤碱,且均需腹腔注射等量的等渗盐水;尼莫地平组大鼠需灌胃30mg/kg尼莫地平,且还需腹腔注射等量的等渗盐水;异钩藤碱高剂量+ADU-S100组大鼠需灌胃20mg/kg异钩藤碱且腹腔注射20mg/kgADU-S100;假手术组、急性脑梗死组大鼠均需灌胃10ml/kg与腹腔注射10ml/kg等渗盐水。给药1次/d,持续2周。建模或实验过程中若有大鼠死亡,则另取SD大鼠按上述方法补足实验用各组大鼠数量。
2.3 Zea-Longa法评估神经功能
末次给药处理24h后,采用Zea-Longa法对所有大鼠进行神经功能评分:0分为正常,无任何神经功能缺损症状;1分为提尾时左侧前肢不能正常自由伸展;2分为走路时向左侧转圈;3分为走路时向左侧倾倒;4分为出现行走困难。
2.4 大鼠认知功能的Morris水迷宫实验检测
神经功能评估结束后,选取所有大鼠进行Morris水迷宫实验。将一圆形水池设置成4个象限,以某一象限作为平台象限,记录大鼠找到该平台的时间即为逃避潜伏期;5d后将平台撤走,让大鼠自由游泳90s,观察并记录大鼠在原平台象限停留次数。
2.5 标本采集
神经功能评分和Morris水迷宫实验结束后,麻醉所有大鼠,每只大鼠收集2ml腹主动脉血,在4℃下离心(3000r/min,离心半径10cm)15min,所得血清用于ELISA检测;再将各组大鼠均分为4等份,每等份包含6只大鼠,分别依次用于脑组织含水量、TTC染色(检测脑梗死体积)、伊文思蓝检测(检测血-脑屏障通透性)、实时定量(quantitative real time,qRT)-PCR;检测闭锁小带蛋白1(zonula occludens protein1, ZO-1)、闭合蛋白(occludin)信使核糖核酸(messenger ribonucleic acid, mRNA)表达和免疫印迹检测(检测STING、p-TBK1、p-IRF3蛋白表达)。
2.6 大鼠血清中IL-6、TNF-α水平的ELISA检测
按照ELISA试剂盒说明书,使用酶标仪测定大鼠血清在450nm波长下的吸光度,并根据标准曲线定量检测血清中IL-6、TNF-α水平。
2.7 脑组织含水量的检测
每组取6只大鼠,腹腔注射2%戊巴比妥钠麻醉并通过颈椎脱臼法处死大鼠,取全脑,称量其湿重;再将大鼠的全脑置于湿度为20%~30%,温度为100℃的烘箱中干燥24h以获得干重。脑组织含水量=(湿重-干重)/湿重×100%。
2.8 大鼠脑梗死体积的TTC染色测定
每组取6只大鼠,麻醉并通过颈椎脱臼法处死大鼠,取新鲜大鼠脑标本,用预冷的磷酸盐缓冲液冲洗3min后,置于-20℃下保存15min,将脑组织切成2mm的冠状切片。再用2%TTC溶液在37℃的黑暗条件下染色20min。用ImageJ1.8.0.345软件计算脑梗死体积,以脑组织呈白色区域为梗死区,脑梗死体积=脑片梗死灶面积×脑片厚度/线性放大倍数。
2.9 血-脑屏障通透性的伊文思蓝检测
每组取6只大鼠,通过尾静脉注射2%伊文思蓝,24h后麻醉大鼠暴露心脏,将针尖插入左心室,血液回流时夹闭针尖口,剪开右心耳,用10ml等渗盐水灌流心脏,当右心耳流出的液体为澄清液体时,通过颈椎脱臼法处死大鼠收集梗死区脑组织,以1.5ml50%三氯乙酸溶液/g脑组织制备脑组织匀浆,离心20min(10000r/min,离心半径10cm)并收集脑组织匀浆上清液,分光光度计检测上清液在620nm处的吸光度值,根据标准曲线计算脑组织中伊文思蓝含量。
2.10 大鼠脑组织中ZO-1、occludin mRNA表达的qRT-PCR检测
每组取剩余的6只大鼠,麻醉并处死大鼠,收集大鼠的梗死区脑组织即呈白色区域的脑组织,使用1mlTrizol试剂在室温下孵育组织匀浆5min以提取总RNA样品。通过NanoDrop分光光度计直接测量260nm处的吸光值,即为RNA浓度,以逆转录生成的互补脱氧核糖核酸(complementary DNA,cDNA)为模板进行PCR反应。GAPDH作为ZO-1、occludin的内参,采用2-ΔΔCT法测定相对定量表达。引物由广州复能基因有限公司合成。引物序列如下:ZO-1:5′-GGTGAAGTGAAGACAATG-3′(正向)和5′-GGTAATATGGTGAAGTTAGAG-3′(反向);occludin:5′-CACCCCCATCTGACTATGCG-3′(正向)和5′-CTGGGTATGATCGCTTGCCA-3′(反向);GAPDH:5′-AGGTCGGTGTGAACGGATTTG-3′(正向)和5′-GGGGTCGTTGATGGCAACA-3′(反向)。
2.11 大鼠脑组织中STING、p-TBK1、p-IRF3蛋白表达的免疫印迹检测
取“2.10”中的梗死区脑组织,用1mlRIPA缓冲液在冰上孵育50mg脑组织匀浆10min后,离心10min(10000r/min,离心半径10cm)以提取总蛋白。使用10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)分离30μg蛋白质,然后恒压100V电转移聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜90min,5%脱脂牛奶与膜孵育1h以阻断膜后,使用一抗STING(1∶6000)、p-TBK1(1∶3000)、p-IRF3(1∶5000)、GAPDH(1∶5000)、IRF3(1∶5000)、TBK1(1∶2000)在4℃下孵育膜24h,再用二抗(1∶3000)孵育膜1h,将洗涤后的膜上加入100μlECL试剂观察蛋白条带,采用UVPGDS8000凝胶成像系统对条带进行量化,采用ImageJ1.8.0.345分析条带的灰度值。
2.12 统计学分析
对所有实验数据使用GraphPad Prism8.0软件进行分析。采用Shapiro-Wilk分析方法对实验数据进行正态性检验,符合正态分布的计量资料以x-±s表示,采用单因素方差分析及事后SNK-q检验进行多组间比较。以P<0.05为差异有统计学意义。
3 结果
3.1 神经功能评分结果
造模成功后给药前急性脑梗死组、异钩藤碱低剂量组、异钩藤碱高剂量组、尼莫地平组、异钩藤碱高剂量+ADU-S100组大鼠平均神经功能评分差异无统计学意义(P>0.05)。末次给药处理24h后,急性脑梗死组平均神经功能评分高于假手术组(P<0.05);与急性脑梗死组比较,异钩藤碱低剂量组、异钩藤碱高剂量组、尼莫地平组大鼠神经功能评分均降低(均P<0.05);与异钩藤碱高剂量组比较,异钩藤碱高剂量+ADU-S100组大鼠神经功能评分升高(P<0.05)。见表1。
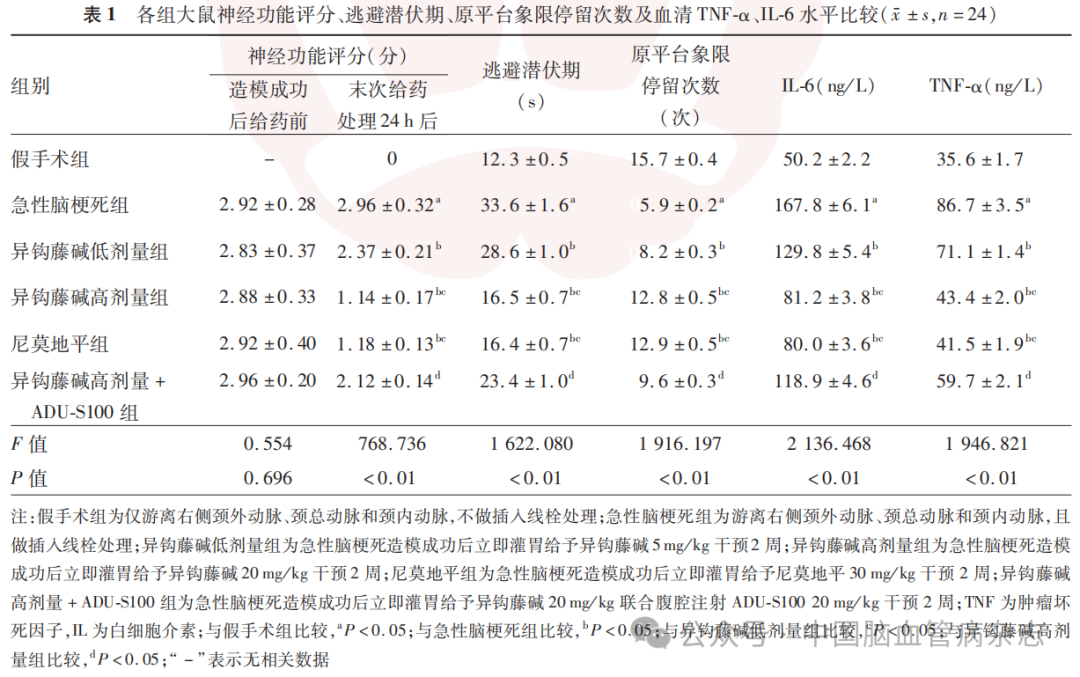
3.2 Morris水迷宫实验结果
与假手术组相比,急性脑梗死组逃避潜伏期延长,原平台象限停留次数减少(均P<0.05);与急性脑梗死组比较,异钩藤碱低剂量组、异钩藤碱高剂量组、尼莫地平组大鼠逃避潜伏期缩短,原平台象限停留次数增加(均P<0.05);与异钩藤碱高剂量组比较,异钩藤碱高剂量+ADU-S100组大鼠逃避潜伏期延长,原平台象限停留次数减少(均P<0.05)。见表1。
3.3 ELISA检测结果
与假手术组比较,急性脑梗死组大鼠血清中IL-6、TNF-α水平升高(均P<0.05);与急性脑梗死组比较,异钩藤碱低剂量组、异钩藤碱高剂量组、尼莫地平组大鼠血清中IL-6、TNF-α水平降低(均P<0.05);与异钩藤碱高剂量组比较,异钩藤碱高剂量+ADU-S100组大鼠血清中IL-6、TNF-α水平均升高(均P<0.05)。见表1。
3.4 大鼠脑组织含水量检测及TTC染色结果
与假手术组比较,急性脑梗死组大鼠脑组织含水量及脑梗死体积升高(均P<0.05);与急性脑梗死组比较,异钩藤碱低剂量组、异钩藤碱高剂量组、尼莫地平组大鼠脑组织含水量及脑梗死体积均降低(均P<0.05);与异钩藤碱高剂量组比较,异钩藤碱高剂量+ADU-S100组大鼠脑组织含水量及脑梗死体积均升高(均P<0.05)。见图1,表2。
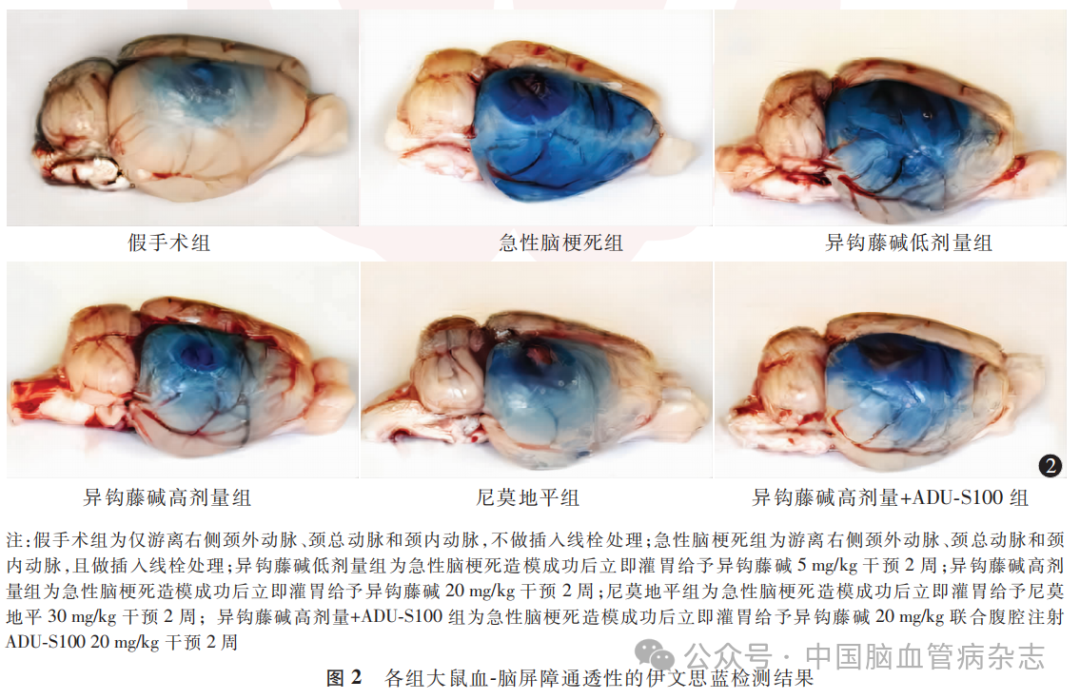
3.5 伊文思蓝检测结果
与假手术组比较,急性脑梗死组大鼠脑组织中伊文思蓝含量升高(P<0.05);与急性脑梗死组比较,异钩藤碱低剂量组、异钩藤碱高剂量组、尼莫地平组大鼠脑组织中伊文思蓝含量降低(均P<0.05);与异钩藤碱高剂量组比较,异钩藤碱高剂量+ADU-S100组大鼠脑组织中伊文思蓝含量升高(P<0.05)。见图2,表2。
3.6 qRT-PCR检测结果
急性脑梗死组ZO-1、occludin mRNA表达均低于假手术组(均P<0.05);与急性脑梗死组相比,异钩藤碱低、高剂量组及尼莫地平组ZO-1、occludin mRNA表达均升高(均P<0.05);与异钩藤碱高剂量组比较,异钩藤碱高剂量+ADU-S100组大鼠脑组织中ZO-1、occludin mRNA表达均降低(均P<0.05)。见表2。
3.7 免疫印迹检测结果
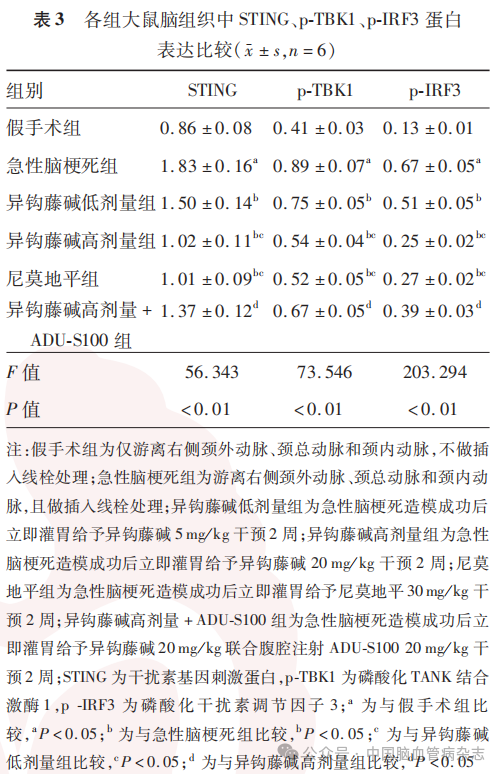
急性脑梗死组STING、p-TBK1、p-IRF3蛋白表达均高于假手术组(均P<0.05);与急性脑梗死组相比,异钩藤碱低、高剂量组及尼莫地平组STING、p-TBK1、p-IRF3蛋白表达均降低(均P<0.05);与异钩藤碱高剂量组比较,异钩藤碱高剂量+ADU-S100组大鼠脑组织中STING、p-TBK1、p-IRF3蛋白表达均升高(均P<0.05)。见图3,表3。

4 讨论
急性脑梗死发生时,脑内血流动力学紊乱,可损害血-脑屏障功能并改变其通透性。当缺血缺氧超过4~6min时,上述危害将进一步放大,可导致认知障碍等神经功能缺损症状。本研究首先通过线栓闭塞大脑中动脉法构建了急性脑梗死模型大鼠,结果显示,给药前急性脑梗死组大鼠神经功能评分为(2.92±0.28)分,脑梗死体积为 (28.6±1.3)㎜³,表明急性脑梗死大鼠存在神经功能障碍。脑水肿是导致脑损伤大鼠神经功能障碍的原因之一,ZO-1、occludin是在维持血-脑屏障完整性方面发挥着重要作用的因子,可用于评估血-脑屏障是否被破坏。同时Morris水迷宫实验是鼠类模型中评估认知障碍最常用的行为学方法,本研究结果显示,与假手术组相比,急性脑梗死组大鼠原平台象限停留次数减少,逃避潜伏期延长,脑组织含水量、伊文思蓝含量升高,ZO-1、occludin mRNA表达水平降低(均P<0.05),表明急性脑梗死大鼠血-脑屏障被破坏,存在脑水肿和认知障碍。既往研究表明,血-脑屏障损伤可促进卒中后脑水肿的发生和发展,血-脑屏障破坏(表现为中脑动脉闭塞组小鼠ZO-1、occludin表达低于对照组)可以加剧小鼠卒中后的认知障碍(表现为与对照组相比,中脑动脉闭塞组小鼠逃避潜伏期延长,平台穿越次数减少,目标区域的距离缩短),提示血-脑屏障破坏、脑水肿与急性脑梗死后的认知障碍存在着一定的联系。此外,已有研究显示,与假手术组比较,急性脑梗死组大鼠血清中IL-6[(89±12)ng/L比(20±4)ng/L, P<0.01]、TNF-α[(16.2±2.1)μg/L比(5.8±0.7)μg/L, P<0.01]水平呈异常升高状态。本研究显示,与假手术组相比,急性脑梗死组大鼠原平台象限停留次数减少,逃避潜伏期延长,血清中IL-6、TNF-α水平升高,表明急性脑梗死大鼠存在炎症反应及认知障碍。既往研究表明,炎症反应参与了急性脑梗死后的认知功能障碍,这主要是因为炎症会损伤机体的神经细胞,使得机体释放出更多的炎症因子,破坏神经环路的完整性,提示炎症反应可能也参与了急性脑梗死大鼠认知障碍过程。基于上述结果,提示抑制炎症、减少血-脑屏障损伤、降低脑水肿程度可能成为改善急性脑梗死后认知障碍的有效方式之一。
异钩藤碱是从钩藤中分离得到的生物碱类化合物,常用于心血管疾病和中枢神经系统疾病的临床治疗,对缺血诱导的神经元损伤具有保护作用。研究表明,与急性脑梗死组比较,应用异钩藤碱[20mg/(kg·d),每天1次,连续7d]可降低缺血性卒中大鼠模型的Zea-Longa神经功能缺损评分[(2.34±0.29)分比(3.46±0.36)分,P<0.05],提示异钩藤碱可能有助于减轻缺血性卒中大鼠模型神经功能缺损;本研究显示,与急性脑梗死组比较,异钩藤碱低剂量组、异钩藤碱高剂量组大鼠神经功能评分、脑组织含水量、血清TNF-α及IL-6水平、脑梗死体积、脑组织中伊文思蓝含量降低,脑组织中ZO-1、occludin mRNA表达升高,逃避潜伏期缩短,原平台象限停留次数增加(均P<0.05),表明异钩藤碱可抑制急性脑梗死大鼠炎症反应、减少血-脑屏障损伤、降低脑水肿程度,并改善认知障碍。尼莫地平是临床上常用于改善急性脑梗死患者神经功能的药物,本实验将该药物设置为阳性对照药物,结果显示,尼莫地平组与低剂量异钩藤碱组在急性脑梗死大鼠给药后神经功能评分、逃避潜伏期、原平台象限停留次数的组间差异均无统计学意义(均P>0.05),提示异钩藤碱可能成为改善急性脑梗死后认知障碍的潜在有效药物之一,但其机制尚不清楚。
既往研究显示,STING/TBK1/IRF3信号通路在神经系统疾病中具有调节作用,如抑制STING/TBK1/IRF3信号通路可改善慢性脑灌注不足大鼠认知障碍,下调STING/TBK1/IRF3信号通路可改善血管性痴呆大鼠认知障碍。本研究中,与假手术组比较,急性脑梗死大鼠脑组织中STING、p-TBK1、p-IRF3蛋白表达较高,但异钩藤碱可抑制急性脑梗死大鼠脑组织中STING、p-TBK1、p-IRF3蛋白表达,且与异钩藤碱低剂量组比较,异钩藤碱高剂量组大鼠脑组织中STING、p-TBK1、p-IRF3蛋白表达降低,提示高异钩藤碱剂量,抑制STING、p-TBK1、p-IRF3蛋白表达的作用较低剂量好,提示异钩藤碱可能在抑制STING/TBK1/IRF3信号通路激活方面发挥作用。为了验证异钩藤碱抑制急性脑梗死大鼠炎症反应、减少血-脑屏障损伤、降低脑水肿程度、改善认知障碍的机制是否与抑制STING/TBK1/IRF3信号通路有关,本实验用STING激动剂ADU-S100(以激活STING/TBK1/IRF3信号通路)和高剂量异钩藤碱共同处理急性脑梗死大鼠,结果显示,与异钩藤碱高剂量组比较,异钩藤碱高剂量+ADU-S100组神经功能评分、脑组织含水量、TNF-α、IL-6、脑梗死体积、脑组织中伊文思蓝含量均升高,脑组织中ZO-1、occludin mRNA表达降低,逃避潜伏期延长,原平台象限停留次数减少,表明ADU-S100减弱了高剂量异钩藤碱对急性脑梗死大鼠神经功能评分、逃避潜伏期、原平台象限停留次数、炎症反应、血-脑屏障损伤、脑水肿程度的影响,提示异钩藤碱可能是通过阻断STING/TBK1/IRF3信号通路抑制炎症反应、减少血-脑屏障损伤、降低脑水肿程度,进而改善急性脑梗死大鼠认知障碍的。
综上所述,异钩藤碱能够抑制急性脑梗死大鼠炎症反应、减少血-脑屏障损伤、降低脑水肿程度,改善认知障碍,还可抑制STING/TBK1/IRF3通路,同时STING激动剂ADU-S100能够逆转高剂量异钩藤碱对急性脑梗死大鼠的影响,表明其机制可能与抑制STING/TBK1/IRF3通路有关。该研究可能为临床上急性脑梗死的治疗提供新的参考依据。然而,本研究尚存在着一定的局限性,异钩藤碱为中药,若用药时间太短则对急性脑梗死的改善作用并不太明显,故本研究选取了给药2周后进行TTC染色,但TTC染色一般用于急性期脑梗的检测,如脑梗死发生后1、3、5、7d时的评估,本研究中选取的TTC染色时间点可能会对实验结果产生一定的影响,后期将继续优化设计实验探究验证。

