管理脓毒症和脓毒性休克患者内皮糖萼的有益方式:从拯救脓毒症运动指南的角度来看
时间:2024-08-26 23:03:11 热度:37.1℃ 作者:网络
摘要
在脓毒症中维持组织灌注依赖于由内皮糖萼提供的血管完整性,内皮糖萼是覆盖血管腔表面的临界层。糖萼由蛋白多糖、糖胺聚糖和功能性血浆蛋白组成,这些成分对于抗血栓形成、调节张力、控制通透性以及减少内皮细胞与白细胞和血小板的相互作用至关重要。在脓毒症中,由于血栓炎症,糖萼的降解是显著的,脓毒症和脓毒性休克的治疗可能会通过额外的糖萼损伤加剧内皮病变。因此,应考虑旨在保护糖萼完整性的治疗策略,包括调整液体容量复苏、最小化儿茶酚胺的使用、控制高血糖以及潜在使用皮质类固醇和抗凝剂。在这篇综述中,我们探讨了与2021年生存脓毒症运动指南中推荐的治疗策略一致的治疗策略,特别强调了关于糖萼保护的证据。
背景
脓毒症是一种由感染引起的器官功能障碍的危重状态。由于宿主免疫反应失调导致的组织微循环障碍被认为是脓毒症患者器官功能障碍的直接机制。脓毒症中的微血管功能障碍包括血管扩张、内皮抗血栓形成能力的丧失、血管-血液细胞相互作用的上调以及通透性的增加,所有这些都在疾病进展中发挥关键作用。近期研究表明,脓毒症中的微循环损伤和内皮病变是由内皮糖萼损伤引发的,保护糖萼及其功能对于维持器官功能至关重要。尽管当前的全球拯救脓毒症运动指南2021年版(SSCG 2021)没有涉及内皮病变,但一些建议与糖萼保护策略相一致。在这篇综述中,我们介绍了与SSCG 2021相关的糖萼保护策略。我们希望未来的指南将提出专门旨在维持糖萼完整性的建议。
糖萼的结构和功能
内皮糖萼是一种富含碳水化合物的凝胶状层,厚度可达3微米,覆盖整个血管腔表面。它主要由膜结合蛋白多糖(如Syndecan和Glypican)、高度硫酸化的分泌型糖胺聚糖侧链(如肝素硫酸和软骨素硫酸)以及高分子量的多糖透明质酸组成。亲水性多糖保留大量水分,并结合生理性血浆蛋白如白蛋白和抗凝血酶(图1)。糖萼调节流动阻力、血管通透性、血管张力、抗血栓形成性和炎症反应。其中,血管通透性的调节功能对传统思维产生了最大的影响。内皮糖萼是影响毛细血管内外静水压和渗透压差异的关键因素。糖萼的认识导致了原始“Starling原理”的修正,该原理没有考虑到糖萼减少的液体外渗,而修正后的Starling模型更好地解释了液体跨血管调节和对液体复苏的反应。
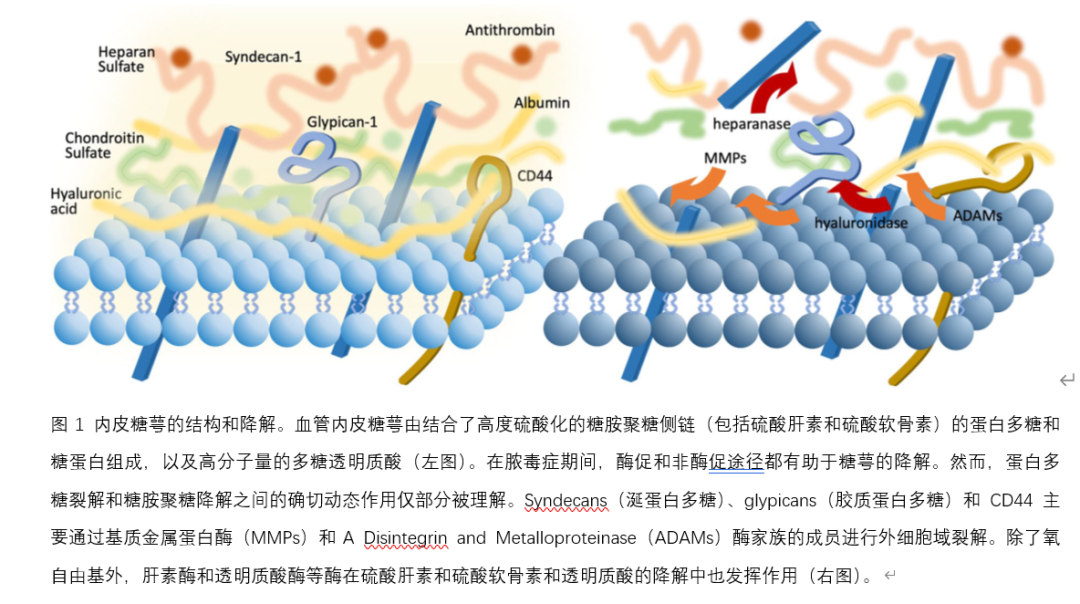
脓毒症中的糖萼损伤
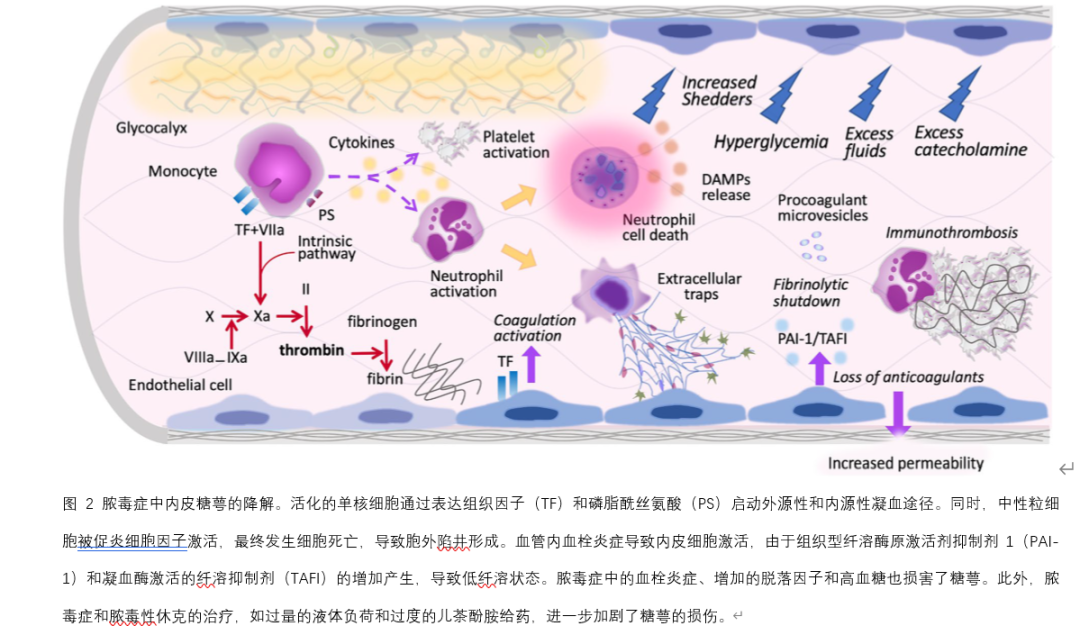
由于糖萼非常脆弱,容易在炎症反应中受损,脓毒症中激活的增加的酶和非酶蛋白水解过程可以进一步造成损伤。涉及的介质包括基质金属蛋白酶(MMPs)、肝素酶、透明质酸酶、凝血酶、弹性蛋白酶和活性氧(图2)。Nieuwdorp等人证明,低剂量内毒素降低了健康志愿者的糖萼厚度,从0.6微米到0.3微米。血管内炎症与糖萼降解密切相关,导致血管通透性增加、水肿、获得性血栓形成倾向以及中性粒细胞和血小板的锚定和粘附。糖萼的紊乱与脓毒症中的器官功能障碍和高死亡率相关。糖萼的破坏导致脓毒症中的毛细血管渗漏综合征(CLS),表现为从血管内到血管外的过量液体转移,导致血管内低血容量、间质水肿和组织低灌注。糖萼的破坏还暴露了粘附分子,如细胞间粘附分子-1(ICAM-1)、血管细胞粘附分子-1(VCAM-1)和P选择素(图3)。这些结构变化促进了血细胞粘附,并上调了炎症细胞与凝血之间的串扰。血小板和白细胞之间的增强相互作用诱导中性粒细胞胞外捕获(NETs)的形成,进一步增加内皮损伤并促进血栓炎症。
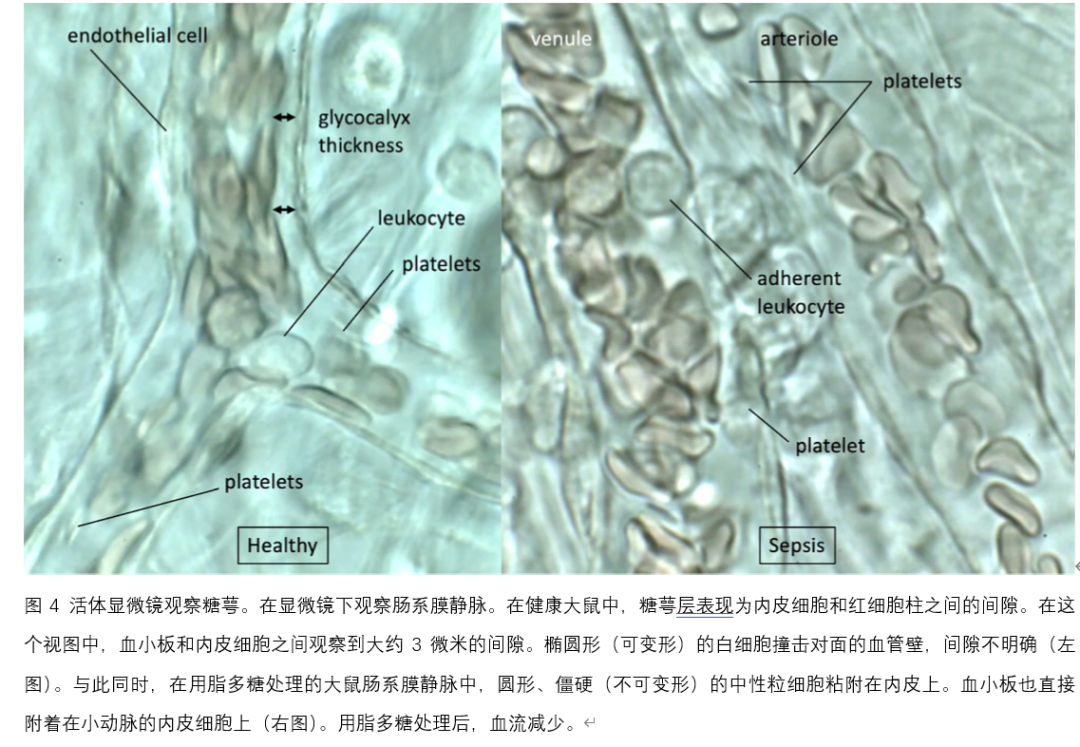
使用活体显微镜估计内皮损伤
在实验模型中,通过微循环的活体显微镜观察报告了内皮损伤,但在患者中获得清晰且明确的视野证明是具有挑战性的(图4)。目前,有两种临床适用的糖萼损伤评估措施:(i)循环降解糖萼成分的测量,如Syndecan、肝素硫酸和透明质酸,以及(ii)活体显微镜观察。实时评估糖萼是具有挑战性的,但使用带有分析软件的侧流暗场视频显微镜(GlycoCheck®)进行舌下微循环血流观察,可以在患者中检测到糖萼损伤。揭示糖萼损伤与微血管功能障碍之间的关系,以及它们的预后和治疗意义,预计将为脓毒症的新型治疗方法的开发提供有价值的见解。
糖萼损伤和毛细血管渗漏综合征
在各种危重病患者中,系统性水肿、低血容量和血流动力学不稳定的同时存在被称为CLS。CLS已知与延迟拔管、在ICU中的时间更长以及更高的可能性依赖于血管活性药物有关。迄今为止,尚无既定的定义或标准化的诊断标准来描述这种状况。Wollborn等人设计的研究旨在识别不同类型危重病患者CLS的共同特征。由于血管内皮细胞的损伤,特别是糖萼损伤,深入参与了CLS的发病机制,他们利用了各种技术,如血清生物标志物的测定(血管生成素-2、Syndecan-1、细胞内粘附分子-1、乳酸和白细胞介素-6)、活体显微镜观察和非侵入性生物电阻抗分析,他们发现血管生成素-2的浓度与CLS的发展最显著相关。血管生成素-2,储存在内皮细胞的Weibel-Palade体中,并在刺激下迅速释放,已知与内皮稳定受体Tie2结合并诱导糖萼迅速丢失。值得注意的是,毛细血管渗漏综合征(Capillary Leak Syndrome, CLS)并不是发生在所有危重病患者身上,而是特定一些患者,特别是心脏手术后的患者。这种情况可能导致体液和蛋白质从血管内向外渗漏,引起全身性水肿、低血容量和血流动力学不稳定。心脏手术患者可能因为手术过程中对血管和组织的影响,更容易发展为CLS,需要特别的监护和治疗措施。因此,识别风险因素并确定评分系统将有助于预测和诊断危重病患者的CLS。
糖萼的保护
在脓毒症管理中,保护和维持糖萼至关重要。尽管当前的全球指南没有提出针对糖萼保护的具体治疗,但一些建议被认为是“友好的”,以维持糖萼完整性。保护和恢复糖萼有助于防止血管收缩、组织水肿和白细胞/血小板粘附,从而减轻炎症、血栓形成和组织缺氧,这些都是脓毒症管理的关键方面。以下部分介绍了脓毒症管理中糖萼保护的实用方法。
胶体替代
大量晶体液复苏用于脓毒症和脓毒性休克可能会增加心力衰竭和肺水肿的风险,这反过来又与死亡率增加有关。尽管白蛋白比晶体液更有可能维持渗透压,但白蛋白在改善结果方面的优越性尚未通过大规模随机对照试验(RCT)确认。然而,最近一项对50名外周灌注时间延长的患者进行的前瞻性研究表明,白蛋白输注(20% 100 mL)比等渗盐水在复苏的脓毒症患者中改善组织灌注更多。在SSCG 2021中,“对于脓毒症或脓毒性休克的成人,建议使用白蛋白而不是单独使用晶体液(弱推荐,低质量证据,建议34)”。白蛋白可能通过将红细胞衍生的S1P传递到内皮,从而保护糖萼,这可以通过抑制金属蛋白酶活性来介导糖萼恢复。然而,临床试验结果并不支持。在一项涉及腹部手术患者的2期多中心RCT中,液体管理包括20%白蛋白(100 mL)和地塞米松,随后向研究组给予200 mL的20%白蛋白,之后给予1000 mL的晶体液;对照组仅接受晶体液,通过Syndecan-1水平评估的糖萼损伤在两组之间没有差异。另一项关于严重脓毒症或脓毒性休克的白蛋白替代的多中心RCT的事后分析(ALBIOS)报告称,接受白蛋白治疗的队列中可溶性VE-cadherin减少,但S1P和Syndecan-1没有显著变化。
除了白蛋白,使用新鲜冷冻血浆(FFP)的胶体治疗已被提出以保护糖萼。Diebel等人在体外低氧/再氧合模型中展示了血浆对糖萼的保护作用,确切的机制尚不清楚,但可能代表纤维蛋白原/Syndecan-1增加应激纤维的能力。此外,血浆/FFP含有生理氧化酶、蛋白酶和基质金属蛋白酶抑制剂,可能有助于维持糖萼,并且与晶体液相比,血浆/FFP在复苏期间减少了液体需求。最近的研究报告了血浆置换在严重脓毒症和脓毒性休克中的有益效果。在一项80名非显性DIC阶段的儿童脓毒症/脓毒性休克试验中,早期给予FFP、低剂量肝素(LMWH)和氨甲环酸改善了生存率并防止了显性播散性血管内凝血(DIC)的进展,没有增加出血风险。在另一项涉及31名脓毒性休克患者的研究中,早期血浆置换减少了促凝和抗凝因子之间的不平衡。SSCG 2021中没有推荐FFP或血浆置换(建议60)。然而,这些有限效果的研究几乎与指南同时发表,未来需要指南审慎的对待这些研究。
与白蛋白相反,合成胶体的保护作用尚未报告。一项对严重脓毒症患者使用羟乙基淀粉(130/0.4)的RCT显示,在第90天增加了死亡风险。在动物模型中,6%羟乙基淀粉(130/0.4)对糖萼完整性提供了保护作用,并在脓毒症中减弱了血管通透性的增加。相反,Kammer等人在对外科患者进行的RCT的事后分析中,检查了6%羟乙基淀粉(130/0.4)和5%白蛋白对凝血和糖萼参数的影响。尽管接受羟乙基淀粉治疗的患者与接受白蛋白治疗的患者相比,在血栓弹力图结果中显示出更大的异常,但在糖萼脱落、部分凝血活酶时间、凝血酶原时间、纤维蛋白原水平方面没有显著差异。在SSCG 2021中,也不推荐使用淀粉或明胶进行成人脓毒症或脓毒性休克的复苏(建议35和36)。
儿茶酚胺限制
血管扩张导致难治性低血压,归因于脓毒性循环衰竭,涉及大量产生诸如一氧化氮和前列腺素等血管舒张剂。液体复苏和儿茶酚胺给药是解决这个问题的基本方法。然而,在临床上使用时,严重的脓毒性休克需要非常高剂量的儿茶酚胺进行复苏。Martin等人在体外模型中证明了与儿茶酚胺相关的糖萼脱落增加。Ostrowski等人在健康志愿者接受内毒素输注的情况下,检查了儿茶酚胺和Syndecan-1之间的关系,并发现血浆儿茶酚胺水平与Syndecan-1水平呈正相关。儿茶酚胺通过增加膜锚定蛋白如MMPs和ADAMs(一种解整合素和金属蛋白酶)的活性来降解糖萼。MMPs和ADAMs降解细胞外基质,包括糖萼,已知蛋白酶的活性会因儿茶酚胺而增加,因为它们在脓毒症和脓毒性休克中是如此。内源性去甲肾上腺素水平已与血浆Syndecan-1水平相关;然而,这一直是在伴有血栓炎症的脓毒症背景下,这可能会直接损伤糖萼。
DIC、肢体缺血和末梢青紫在脓毒性休克和休克性肝病患者中很常见。这些患者也是血管扩张的,需要高剂量的血管加压治疗。因此,尽管使用高剂量去甲肾上腺素(剂量范围从0.58−4 mcg/kg/min),但在这些危重病患者中直接肢体或数字缺血或坏死的证据并不常见,发生频率低至1.6−8%,而且通常没有相关的DIC或休克肝。重要的是,没有直接文献支持高剂量血管加压剂是对称性周围性肢体坏死或独立于脓毒症或脓毒性休克的血管损伤的主要原因。
在SSCG 2021中,建议“对于使用去甲肾上腺素的脓毒性休克成人,且平均动脉压水平不足,我们建议添加加压素而不是增加去甲肾上腺素的剂量(弱推荐,中等质量证据,建议38)”。通常在去甲肾上腺素剂量达到0.25−0.5 μg/kg/min时考虑添加加压素,但这种做法没有得到坚实的科学证据支持。与其他人一样,这一建议不是为了保护糖萼而制定的,旨在尽可能减少儿茶酚胺的不良影响,包括受损的肠系膜和外周循环。因此,未来的研究应该调查临床案例中儿茶酚胺剂量的适当性。
限制性液体疗法
早期液体复苏对于最小化组织低灌注的有害影响很重要。然而,通过升高的Syndecan-1测量的糖萼损伤与复苏所需的液体量有关。尽管高血容量可能对糖萼有害,但最近的证据表明,用于恢复器官灌注的液体过量可能会损害血管完整性并导致器官功能障碍。以前的研究表明,高血容量诱导心房利钠肽释放(ANP),导致糖萼降解。ANP是由于血管内容量过负荷引起的心房扩张而释放的,并且也被认为是潜在的内皮糖萼剪切酶。很自然地想到ANP通过增加内皮微血管通透性来部分抵消容量过负荷,通过内皮糖萼降解促进液体外渗。Jacob等人在豚鼠中证明了ANP效应与血管内糖萼脱落之间的正相关关系,并通过电子显微镜形态学确认了这种效应。综合来看,液体过负荷可能通过糖萼损伤损害组织循环;然而,休克和脓毒症也是重要的促成因素。Byrne等人报告说,在内毒素血症的绵羊模型中,液体复苏导致血管加压药需求的矛盾增加,并没有改善任何微循环或器官损伤标志物。然而,推广到临床建议是不确定的。
一项RCT研究了151名成人脓毒性休克患者的限制性复苏液体方案,并报告说限制性液体疗法导致急性肾损伤恶化的频率较低,死亡率较低。然而,随后一项涉及1554名脓毒性休克患者的较大RCT未能显示限制性静脉液体方案有更好的结果。最终,限制性液体疗法的影响仍然不确定,特别是在脓毒症的情况下;尽管如此,根据发表的研究,重要的是持续评估患者对液体复苏的反应。SSCG 2021报告说,没有足够的证据推荐限制性液体策略而不是自由液体策略(建议45)。关于限制性液体疗法有效性的研究仍在继续,随着JSSCG 2021的发布,还有额外的研究。尽管没有一项证明限制性液体疗法的好处,但一项系统综述和荟萃分析得出结论,与较高液体量相比,较低液体量导致成人脓毒症患者的全因死亡率几乎没有差异。
另一种可能减少液体量管理的方法是使用高渗液体。Smart等人报告说,在评估3.0%盐水与等渗盐水减少脓毒症患者Syndecan-1和透明质酸时没有差异。然而,应该注意,高钠血症也可能导致糖萼降解。Martin等人报告说,将人脐静脉内皮细胞暴露于低氧/再氧合和肾上腺素,以模拟休克样损伤,随后用高渗溶液处理,导致内皮糖萼降解。SSCG 2021中没有关于高渗溶液的建议。
皮质类固醇
经过数十年的试验结果冲突后,现在推荐使用低剂量糖皮质激素治疗难治性休克。根据2021年的《生存脓毒症运动指南》(SSCG 2021),“对于成人脓毒性休克患者,如果持续需要血管加压药物治疗,我们建议使用静脉注射皮质类固醇”(弱推荐;中等质量证据,建议58)。糖皮质激素被认为是抗炎药物,能够减少促炎细胞因子和炎症介质,因此,它们抑制白细胞的激活,并可能提供对糖萼的保护。在动物模型中,Chappell等人展示了在肿瘤坏死因子诱导的动物模型中,氢化可的松和抗凝血酶对内皮糖萼的保护效果,尽管这些保护效果尚未在临床上得到确认。Pesonen等人在心脏手术后的新生儿中进行了一项随机对照试验(RCT),并检查了术中给予甲泼尼龙(30 mg/kg)的效果。研究报告称,在心肺转流术后和术后6小时,Syndecan-1的减少。相比之下,Yanase等人在进行大型腹部手术的患者中进行了2期RCT,并报告称,术后静脉注射地塞米松(16 mg)和白蛋白治疗并未减少Syndecan-1。尽管如此,在糖萼损伤常见的危重COVID-19患者中,类固醇通过改善内皮损伤而产生的有益效果是被认可的。
抗凝剂
血栓炎症在脓毒症组织损伤进展中发挥重要作用。尽管已经进行了各种试验来检查抗凝治疗的效果,但缺乏支持有益作用的有力证据。SSCG 2021中没有讨论脓毒症的抗凝治疗,只推荐了用于血栓预防的低分子量肝素。“对于脓毒症或脓毒性休克的成人,我们建议使用低分子量肝素而不是普通肝素进行静脉血栓栓塞(VTE)预防(强烈推荐,中等质量证据,建议65)”。脓毒症患者有深静脉血栓(DVT)和肺栓塞(PE)的风险,危重病患者的VTE发生率据报道为4%至15%。因此,通过LMHW预防VTE很重要。此外,动物数据表明肝素对糖萼具有保护性质。Yini等人在脓毒性休克的犬模型中证明了与UFH相关的糖萼脱落减少,LMWH对糖萼脱落的影响已在大鼠模型中显示。然而,肝素对脓毒症和人类患者器官损伤的影响仍然不确定。
除了肝素,内源性抗凝剂对糖萼完整性的保护作用也有报道。硫酸肝素是糖萼的糖胺聚糖侧链,作为抗凝血酶的辅因子。抗凝血酶/肝素硫酸有助于维持血管腔的抗血栓性质。由于脓毒症中抗凝血酶活性显著降低,抗凝血酶补充可以调节脓毒症中的血栓炎症。先前在大鼠脓毒症模型中关于抗凝血酶补充的报告表明,通过与血管硫酸肝素结合,能够稳定糖萼。Chappell等人也在缺血/再灌注损伤的豚鼠模型中报告了抗凝血酶的类似效果。抗凝血酶,一种丝氨酸蛋白酶抑制剂,可以直接抑制丝氨酸蛋白酶凝血酶,这有助于糖萼脱落。在日本脓毒症指南中,重组血栓调节素被推荐用于脓毒症相关的播散性血管内凝血。在用脂多糖处理的小鼠中,重组血栓调节素减轻了肺毛细血管损伤,从而减轻了由内皮损伤引起的急性呼吸窘迫综合征的损伤。
糖萼成分
理论上,外源性给予的糖萼成分如透明质酸可以恢复糖萼结构,尽管这些效果甚至在动物模型或临床上也未得到确认。Tenhunen等人检查了外源性给予的透明质酸是否在腹膜炎的猪模型中对抗血管内容量耗尽并维持内皮糖萼完整性。结果显示,治疗组和对照组之间的每搏输出量变化、血液浓缩和血浆Syndecan-1水平是可比的。Sulodexide是一种类似肝素的化合物,对肝素酶的降解有抵抗力。Sulodexide的保护效果在小鼠脓毒症模型和儿童脓毒性休克中都有报道。目前,SSCG 2021中没有描述糖萼恢复情况;然而,推荐使用Sulodexide治疗COVID-19患者。
血糖控制
高血糖已知与糖萼损伤相关,已在糖尿病患者中报告糖萼降解。在糖尿病患者中,血糖控制与减少心血管事件相关。在急性炎症模型中,高血糖被报告为促进体外TNF诱导的糖萼降解。Nieuwdorp等人报告称,高血糖增加了血浆透明质酸水平、内皮功能障碍和凝血激活。这种机制可以通过增加活性氧和晚期糖基化终产品受体(RAGE)的受体激活来解释。我们还检查了高血糖在大鼠模型中的效果,并证明中性粒细胞激活和NET形成参与了糖萼损伤。
在SSCG 2021中,对于脓毒症或脓毒性休克的成人,建议在血糖水平≥180 mg/dL时开始胰岛素治疗(强烈推荐;中等质量证据)。然而,由于低血糖对脓毒症患者有害,通过强化胰岛素治疗进行血糖控制并不是脓毒症管理中当前的趋势,典型的目标血糖范围设定在144–180 mg/dL(建议69)。未来的试验应考虑将糖萼保护作为实现最佳血糖控制的一部分。
维生素C
维生素C作为抗氧化剂和中性粒细胞功能的必需底物,在脓毒症中表现出抗炎作用。一项RCT招募了23名脓毒症患者,并显示通过维生素C治疗,糖萼更厚,灌注毛细血管的比例更高。另一项RCT的事后研究检查了高剂量维生素C在脓毒症引起的急性呼吸窘迫综合征(CITRIS-ALI)中的效果,证明维生素C治疗减少了Syndecan-1。然而,在原始RCT中,维生素C并没有显著改善器官功能评分或炎症和血管损伤标志物(例如可溶性血栓调节素)。此外,最新的RCT显示了意想不到的结果;在接受血管加压药的成年脓毒症患者中,静脉注射维生素C与接受安慰剂的患者相比,在28天内死亡风险和持续器官功能障碍更高。
在SSCG 2021中,建议“反对在脓毒症或脓毒性休克的成人中使用静脉注射维生素C”(弱推荐,低质量证据,建议70)。因此,高剂量维生素C可能不是脓毒症中糖萼保护的合适选择。
结论
鉴于糖萼在维持血管完整性中的关键作用,保护这一重要的血管组成部分是脓毒症管理中的一个重要考虑因素。在这篇综述中,我们探讨了糖萼在脓毒症中的作用,包括有关潜在治疗方式的最新数据。虽然SSCG 2021中的建议并不是为了保护糖萼,但其中一些建议可能被认为是对糖萼有益的。我们建议在未来的脓毒症研究和指南中考虑旨在保护糖萼的治疗策略。


