PNAS:上海交通大学王侃侃/陈竺/陈赛娟等合作发现急性早幼粒细胞白血病转录失调的调控新机制
时间:2024-08-28 18:01:28 热度:37.1℃ 作者:网络
在急性早幼粒细胞白血病(APL)中,早幼粒细胞白血病-维甲酸受体α(PML/RARα)融合蛋白破坏了PML核小体(NBs),导致形成微斑点。然而,作者对PML/RARα介导的微斑点形成及其在APL白血病发生中的作用的理解主要来自形态学观察,缺乏对其背后机制的深入了解。
2024年8月13日,上海交通大学王侃侃,陈竺,陈赛娟和Hai Fang共同通讯在PNAS在线发表题为“Phase separation of PML/RARα and BRD4 coassembled microspeckles governs transcriptional dysregulation in acute promyelocytic leukemia”的研究论文。该研究提供了证据,揭示了液-液相分离(LLPS)是PML/RARα介导微斑点形成的关键机制。该过程由包含大部分PML和小部分RARα的固有无序区(IDR)促进。作者展示了溴域蛋白4(BRD4)在PML/RARα介导的凝聚体内的共组装,与野生型PML形成的NBs有所不同。在没有PML/RARα的情况下,PML NBs和BRD4颗粒作为两个独立的相存在,但在PML/RARα存在的情况下,PML NBs被破坏,并将PML和BRD4重新分布到一个独特的相中,形成了PML/RARα组装的微斑点。
全基因组分析显示,PML/RARα导致的BRD4在基因组上的重新分布,倾向于与超级增强子和广泛启动子区域(SEBPs)结合。在机制上,BRD4被PML/RARα招募到核内凝聚体中,促进BRD4与染色质的结合,从而发挥对APL生存至关重要的转录激活作用。通过化学抑制(如1, 6-己二醇)扰乱LLPS,显著降低了PML/RARα和BRD4在染色质上的共占据,减弱了其靶基因的激活。最后,一系列在APL患者原始样本中的实验验证了PML/RARα通过凝聚体形成微斑点,招募BRD4共同组装凝聚体,并共同占据SEBP区域。作者的研究揭示了PML/RARα组装的微斑点的生物物理、病理和转录动态,强调了BRD4在介导转录激活和PML/RARα启动APL中的重要性。
癌细胞中经常观察到异常的核形态,这些异常与基因调控和DNA损伤修复等关键生物反应有关。然而,改变的核结构的分子组成和功能,特别是其特异性、调控功能和致癌活性,仍然在很大程度上未被探索。在急性早幼粒细胞白血病(APL)中,由t(15;17)易位产生的PML/RARα融合癌蛋白长期以来在显微镜下被观察到能够破坏早幼粒细胞白血病蛋白(PML)核小体(NBs),并随后形成微斑点。在用维甲酸(RA)或三氧化二砷(ATO)治疗期间,PML NBs的恢复已有报道。然而,作者对PML/RARα介导的微斑点的了解仍停留在形态学观察的层面,关于这些异常细胞器在APL中的作用机制仍然不清楚。这些PML/RARα组装的微斑点在APL病理生理学中的组成成分和细胞功能尚未阐明。
近年来,凝聚体生物学的进展表明PML NBs是无膜凝聚体。一般来说,凝聚体可以在真核细胞中演变为隔离并浓缩细胞内分子,提供超越传统分子生物学的时空调控机制。液-液相分离(LLPS)这一物理过程驱动了无膜凝聚体的组装。LLPS由模块化生物大分子和/或蛋白质固有无序区(IDRs)之间的多价相互作用调控,其重要性在驱动细胞功能和癌症中的功能障碍方面得到了证明。据报道,PML NBs可以抑制增殖,促进细胞凋亡和/或衰老,从而确立了PML作为肿瘤抑制因子的作用。尽管PML NBs的破坏被认为对白血病的发生至关重要,但PML敲除小鼠(即破坏PML NBs)仅发展出某些类型的实体瘤,而非APL或髓样白血病。这一观察表明,单靠PML NBs的破坏不足以引发APL白血病。基于上述发现,作者提出PML/RARα微斑点本身可能通过未探索的机制促成了APL的白血病发生。
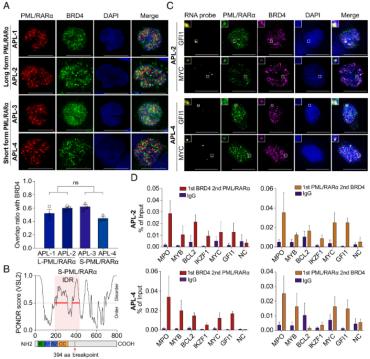
长型和短型PML/RARα与BRD4在APL母细胞SEBP区聚集形成凝聚体(图片源自PNAS)
核内LLPS的生理和病理重要性日益受到关注,主要由于其在超级增强子(SEs)的形成、功能和脆弱性中的参与。SEs是增强子调控元件的簇,与结合的转录调控因子一起控制对细胞特性和癌症恶性至关重要的基因表达。在SEs处,据认为表观遗传调控因子如溴域蛋白4(BRD4)及其他许多转录因子(TFs)形成相分离的凝聚体,这些凝聚体通过隔离并浓缩转录装置来激活基因表达。
作为一个起始因子,PML/RARα结合到染色质调控元件上,干扰正常的造血转录程序,促进APL的发展。长期以来,人们认为PML/RARα主要通过招募共抑制因子对造血主导TFs、维甲酸受体α(RARα)和/或PU.1的靶基因施加转录抑制作用。然而,作者最近的研究为PML/RARα的转录活性增加了一个激活的维度。除了经典的转录抑制活性,作者还证明PML/RARα可以诱导APL特异性的SEs的形成,增加转录突发的频率,并决定APL细胞的特性和命运。核内的基因表达激活需要特定的时空条件,但PML/RARα微斑点是否提供了这种转录活性所需的生物物理环境和空间组织仍不清楚。
本研究提供了令人信服的证据,证明了PML/RARα在建立由LLPS驱动的微斑点中的关键作用,其中BRD4对这些结构的功能属性有重要贡献。作者的研究结果为PML/RARα的功能提供了病理和转录方面的见解,并为作者对APL白血病发生机制的理解增加了生物物理学的维度。
参考消息:
https://doi.org/10.1073/pnas.2407285121


