重症领域顶级期刊发表综述:CAR-T相关毒性的管理
时间:2024-08-30 14:01:08 热度:37.1℃ 作者:网络
CAR-T相关毒性
CAR-T细胞疗法显著改善了多种血液系统恶性肿瘤的预后,但也可能发生危及生命的并发症。因此,了解这些并发症的治疗和管理极为重要,特别是对于治疗中心和ICU。
重症领域顶级期刊《Intensive Care Medicine》近日发表综述,德国学者为CAR-T细胞相关并发症的诊断、管理和治疗提供了建议,如细胞因子释放综合征(CRS)、免疫效应细胞相关神经毒性综合征(ICANS)、血液毒性、低丙种球蛋白血症和CAR-T细胞诱导的假性进展等。德国人写的英文稍显拗口,此外文末附上了近期发表的多篇关于CAR-T相关毒性管理的综述。

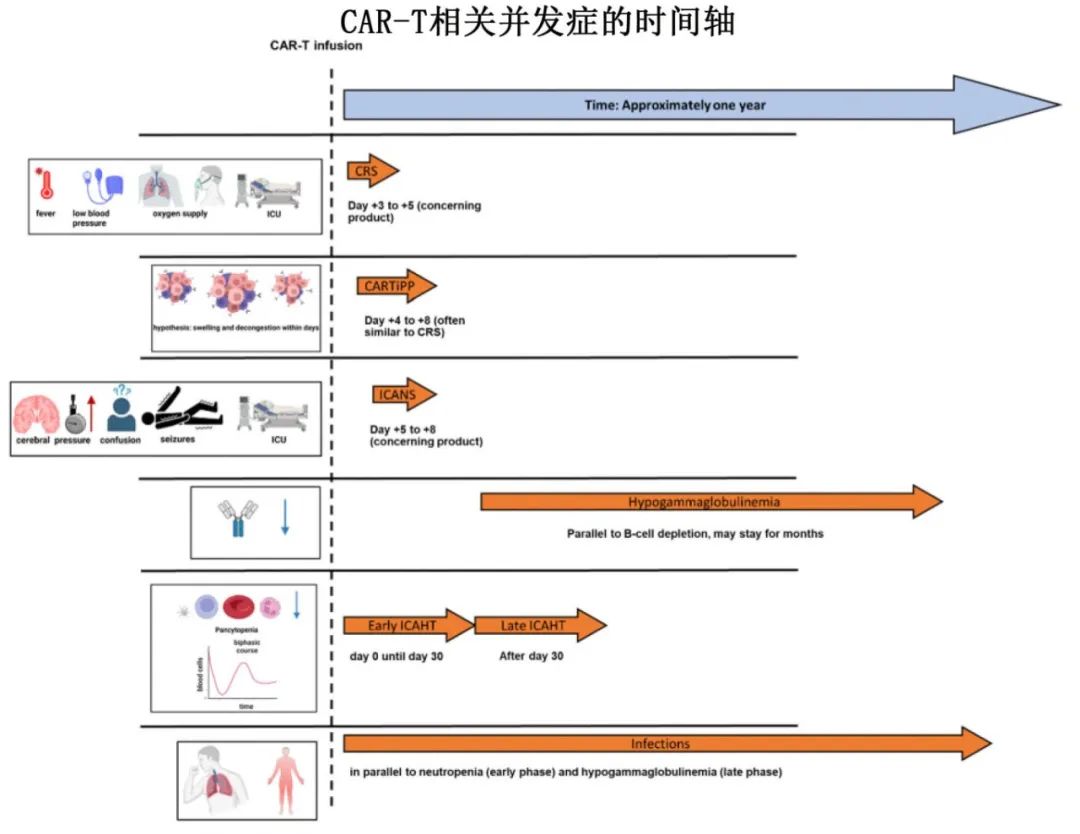
CAR-T治疗的免疫功能
采集T细胞并通过病毒载体或基因编辑技术进行工程改造以表达嵌合抗原受体,CAR-T细胞疗法利用免疫系统靶向并摧毁癌细胞。CAR-T细胞在与显示特定抗原(如CD19、BCMA或GPRC5D)的癌细胞结合后被激活,启动靶向肿瘤识别和CAR-T细胞激活的信号。该激活可触发细胞毒性分子的释放,导致癌细胞死亡,招募免疫成分增强反应,并可分化为记忆T细胞,用于长期监测和潜在的复发保护。CAR构建体中的CD28和4-1BB等共刺激结构域通过提供额外的信号提示来增强CAR-T细胞的功能和持久性,从而导致不同的分子和功能结果。CD28可促进T细胞快速扩增,4-1BB可增强细胞存活、记忆样表型发展和持续抗肿瘤反应;这些区域的差异会影响CAR-T细胞产品的治疗效果和持久性,并改变急性副作用的严重程度,在临床应用时需要谨慎考虑。
CAR-T治疗过程的单采-制备-输注流程图大概如下。其中输注前的清淋化疗可导致患者易发生深度骨髓抑制,导致严重中性粒细胞减少、感染风险和造血恢复延迟等不良事件;需要密切监测和及时处理,以减轻并发症。输注后需密切监测患者的副作用,如CRS、各种神经毒性、血液毒性、感染或其他不良事件,其程度取决于肿瘤负荷、年龄、细胞剂量、合并症、时间和使用的具体CAR-T细胞产品等因素。患者易发生神经系统并发症和CRS,治疗后前10天的连续心电图(ECG)和生命参数监测很重要。

细胞因子释放综合征
细胞因子释放综合征(CRS)是CAR-T细治疗的一种严重并发症,其特征为过度的促炎细胞因子释放,通常在输注后几天到一周内出现,表现为发热、疲劳和流感样症状。它由靶抗原接触后活化的CAR-T细胞触发,导致巨噬细胞等免疫细胞活化和细胞因子释放,尤其是IL-6,进一步引起免疫活化、内皮细胞活化、毛细血管渗漏和组织水肿。
强烈的免疫激活放大炎症,加重CRS症状的严重程度,导致类似败血症的情况,并伴有低血压、心动过速和器官功能障碍,症状包括对退烧药耐药的发热、对静脉输液无反应的低血压、呼吸窘迫、缺氧、凝血功能障碍、肾脏和肝脏损害。CRS的严重程度可以使用多种评分系统进行分级。

CRS的一般管理
可通过抑制白介素(IL)-6受体(IL-6-R)直接中断级联反应,例如托珠单抗,而低级别CRS可以对症治疗。CAR-T细胞治疗后患者体温高于38℃时应考虑CRS,但也必须排除感染,特别是在清淋化疗后,可能导致中性粒细胞减少,从而引起中性粒细胞减少性发热。如果病灶不明确,则必须在一小时内开始使用对假单胞菌有效的抗生素(哌拉西林/他唑巴坦、亚胺培南、美罗培南、头孢吡肟或头孢他啶)。考虑到在临床实践中区分脓毒症和CRS的复杂性(包括高细胞因子水平),以及考虑到大约10%的患者出现脓毒症(可以模拟CRS),因此患者同时需要对两种情况进行经验性治疗的情况并不罕见。在对发热、低血压、血流动力学不稳定或呼吸短促等其他原因的症状进行快速鉴别诊断后,同时考虑到经常出现的前驱症状,如心动过速或呼吸急促,可以做出(疑似)CRS的诊断,以便及时治疗。
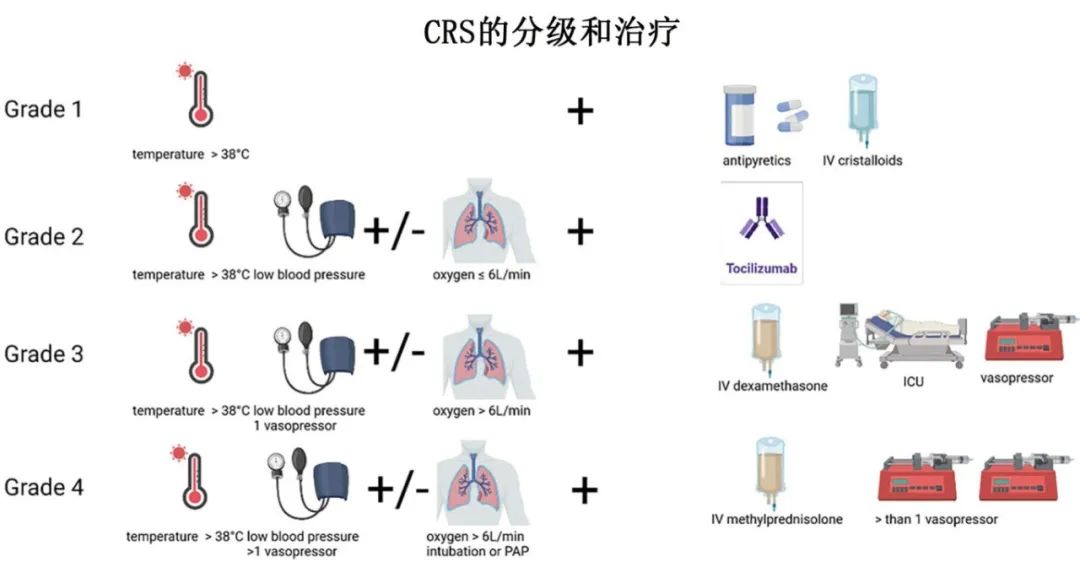
根据CRS级别予以治疗
CAR-T细胞治疗前应通知ICU,以确保及时干预和患者安全。CAR-T细胞治疗后的CRS管理按症状严重程度分为四个等级,每个等级规定具体的干预措施。
1级CRS包括轻微症状,如发烧,无需供氧或血管加压药。治疗包括支持治疗,每2小时监测一次生命体征和退热药物,如对乙酰氨基酚1000毫克静脉注射。对于轻微低血压,考虑静脉晶体液替代治疗。
2级CRS以中度症状为特征,如发热伴低血压或供氧(≤6L/min)。治疗包括托珠单抗(8mg /kg, 8小时后可重复,每日最多4次),对于axicabtagene-ciloleucel,一旦达到2级CRS标准或使用托珠单抗后仍存在低血压,则早期类固醇干预使用地塞米松10mg IV作为单剂量治疗。支持性护理和ICU快速进展准备至关重要;当CRS从1级发展到2级时,应通知ICU,为可能的转移做好准备。
3级CRS提示症状严重,高热、低血压需要血管加压药物支持或供氧(>6L/min),需转至ICU。治疗包括持续生命体征监测、地塞米松(每6小时10毫克静脉注射[q6h,如果没有改善则增加剂量至20毫克)、根据“液体试验”(fluid challenge)原则积极静脉输液,以及托珠单抗治疗。
4级CRS是危及生命的情况,需要多种血管加压药物或严重缺氧时插管,应根据院内感染的ICU风险调整抗生素治疗。大剂量皮质类固醇(每日1000毫克甲强龙)和重症监护是强制性的。Anakinra可用于难治性CRS,剂量可达12mg /kg/天,特别是对其他治疗无反应的4级或高级别患者。对于三线CRS难治患者,可给予环磷酰胺(1.5 g/m[2]),对CAR-T细胞产生不可逆的损伤。
CRS的缓解和恢复
适当的CRS管理后,因为炎症减轻、细胞因子水平下降,一般在几天到几周内症状缓解。在恢复过程中,应每8小时监测一次生命体征,以识别潜在的并发症,如中性粒细胞减少性发热或CRS复发。了解CRS分期是及时处理的关键,从而预防严重并发症。正在进行的研究旨在确定预测性生物标志物,增强治疗策略,提高CAR-T治疗的安全性。
免疫效应细胞相关神经毒性综合征
免疫效应细胞相关神经毒性综合征(ICANS)是一种急性反应,通常发生于CRS之后,但也可发生于CAR-T细胞治疗后的前10天。ICANS是一种神经和/或神经精神综合征,严重程度各不相同。建议从CAR-T细胞输注开始,评估ICE评分,测量定向、语言、注意力和笔迹(见下文)。ICANS多发生于CRS之后,因此没有先前CRS的新神经系统并发症需要鉴别诊断以排除其他原因。


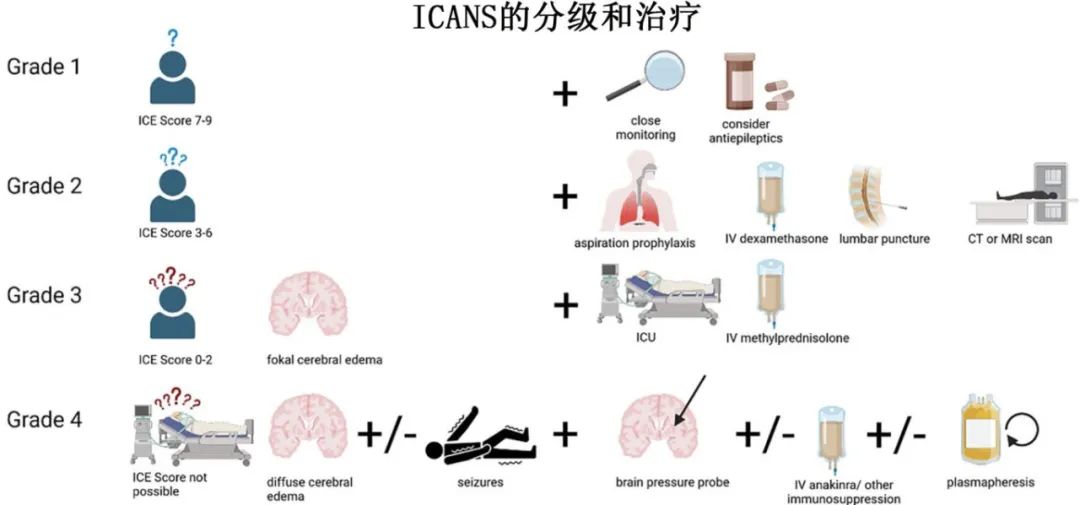
ICANS分级
ICANS的前驱期发生于CAR-T细胞输注后几天内,表现为轻微神经系统症状,如头痛、意识不清和不易察觉的认知变化,同时伴有高血压和心动过速。由于这些症状可能被忽视,严密的测试很有必要,包括免疫效应细胞脑病(ICE)评分。如果ICE评分监测不可行,应通过脑成像排除脑水肿,脑电图(EEG)和双谱指数(BIS)可以监测意识水平并排除致痫电位。对于不明原因心动过缓、高血压或瞳孔不等大,应开始监测颅内压。
1级ICANS症状较轻,包括言语缓慢、思维混乱、注意力难以集中和轻度头痛,ICE评分7-9为1级。诊断包括神经系统检查,而治疗强调支持性护理、症状管理和750 mg左乙拉西坦QD预防癫痫发作。
于2级ICANS (ICE评分3-6),诊断成像、排除性EEG至关重要。腰椎穿刺应根据具体情况进行讨论。由于CAR-T细胞治疗后的患者免疫功能严重受损,因此必须考虑传染性鉴别诊断(即感染性脑膜炎/脑炎)。当怀疑时,应采用严格的诊断方法。因此应考虑使用地塞米松(如果CRS同时发生,则使用托珠单抗)和疑似感染性脑病(即脑膜炎或脑炎)的初始联合治疗,一旦检测结果排除鉴别诊断或削弱不可靠性,就应降级一种治疗路径。
3级和4级ICANS需要强化诊断措施和治疗,包括大剂量皮质类固醇、颅内压监测,确保足够的氧合、正常血压、正常血容量、正常血容量、正常血糖和正常体温。颅内压(ICP)应保持在< 20 mmHg,目标脑灌注压(CPP)为60-70 mmHg,颅内压升高可通过甘露醇或适度过度通气降低。如果由于脑脊液(CSF)中IL-6积累的风险而出现神经学症状,则应停用托珠单抗。在弥漫性大细胞B细胞淋巴瘤(DLBCL)和B急性淋巴细胞白血病(B-ALL)等高增殖疾病中,早期增加皮质类固醇剂量或改用甲强龙也可以预防严重副作用。对于危及生命的4级ICANS,必须在ICU进行积极的管理,给予大剂量甲强龙,并对癫痫发作进行抗癫痫治疗。类固醇难治性高级别ICANS应考虑Anakinra (QID为1mg /kg,最高剂量为100mg)。如上文所述,如果没有其他选择,可考虑使用环磷酰胺,但数据非常有限。
治疗相关运动和神经认知不良事件
对CAR-T细胞治疗期间发生的神经学不良事件的了解仍有限。ICANS是一种有充分证据的神经毒性副作用,但新型CAR-T产品,如ciltacabtagene-autoeucel,与治疗出现的运动和神经认知不良事件(NMT)有关。CARTITUDE-1研究注意到ICANS后的MNTs,表明需要根据临床表现区分ICANS和MNTs,包括ICANS中不典型的运动和性格变化。CARTITUDE-1的安全性分析确定了非ICANS神经毒性症状,如ICANS /CRS恢复后的运动改变和认知能力下降。MNTs的危险因素包括治疗后CAR-T细胞计数高、治疗前细胞因子水平升高,并与较高的基线肿瘤负担和严重的CRS或ICANS有关,因此需要有针对性的预防策略。MNTs的治疗包括类固醇(甲强龙)、静脉注射免疫球蛋白和/或血浆置换,以及必要时神经内科会诊。必须排除鉴别诊断,如病毒感染或其他神经毒性原因。
CAR-T诱导的假性进展
CAR-T细胞治疗后的假性进展与检查点抑制剂治疗(CPI)的情况不同,缺乏全面的理解和描述。虽然CPI诱导的假性进展受益于既定的毒性标准,如RECIST、LUGANO和LYRIC,但CAR-T细胞治疗仅发现少数短暂进展后消退的病例。迄今为止报道的大多数病例中,CAR - T细胞诱导的假性进展(CARTiPP)已显示出临床和/或放射学表现。然而,如果肿瘤在解剖学上位于高度脆弱的区域,如靠近中枢神经系统、大血管或有边界的中空器官,则CARTiPP可能会造成严重后果。CARTiPP的发生率和治疗策略仍未得到充分探讨。建议临床医生考虑假性进展引起的肿瘤肿胀的潜在影响,并评估桥接疗法,如CAR-T前放疗和/或免疫化疗。对于疑似CARTiPP,诊断措施应包括外周测量和影像学评估组织血流量。治疗方案包括皮质类固醇、托珠单抗、环磷酰胺,需要咨询CAR-T经验丰富的临床医生。
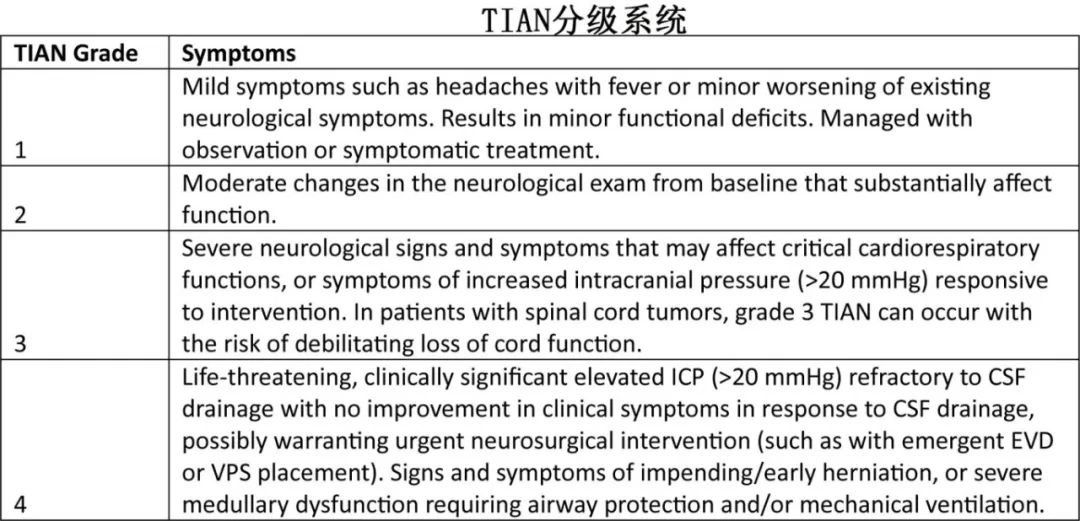
肿瘤炎症相关神经毒性
肿瘤炎症相关神经毒性(TIAN)是脑肿瘤患者一种独特的神经毒性,与系统性ICANS不同。其表现为局部并发症,如颅内压升高或癫痫发作,通常由假进展引起的局部肿胀或炎症诱导的细胞环境变化增强致痫性引起。临床上将TIAN与CARTiPP和ICANS区分开来具有挑战性,其症状包括发热、头痛和与肿瘤位置相关的神经系统障碍,但神经影像学可以显示原始肿瘤病变的进展,而ICANS则表现为弥漫性脑水肿或其他脑病体征。TIAN的严重程度分为四个等级,从轻微症状到需要紧急干预的危及生命的情况。治疗包括早期放射影像学、神经内科会诊、脑电图、生命体征监测和类似ICANS的治疗,包括地塞米松,早期可能升级为甲强龙、anakinra IV,并考虑脑脊液外引流。推荐抗癫痫药如左乙拉西坦。
除了CRS和ICANS等主要并发症外,CAR-T细胞疗法还可能引起额外并发症。非靶抗原的意外相互作用称为off-target off-tumor (OTOT)毒性,可导致免疫相关不良反应, OTOT毒性可引起血液或实体器官损伤并引起继发性并发症。值得关注的并发症包括血液毒性、低丙种球蛋白血症、噬血细胞性淋巴组织细胞增多症(HLH)和巨噬细胞激活综合征(MAS),以及潜在的器官特异性毒性。
免疫效应细胞相关血液毒性
OTOT毒性可能破坏造血功能,称为免疫效应细胞相关血液毒性(ICAHT),首次发现于2019年,大多数证据与CD19 CAR诱导的血细胞减少有关。ICAHT通常表现为双相模式,一半的患者最初从中性粒细胞减少症恢复,三分之一的患者从血小板减少症恢复,随后为复发性血细胞减少症。该模式与治疗阶段相关,最初为清淋治疗后CRS或HLH高峰,第二阶段与早期事件无明确联系。恢复时间和严重程度因共刺激域而异。CD28共刺激axicabtagene-ciloleucel治疗在1-2个月内显示出更快的血细胞减少恢复,而tisagenlecuel治疗的血液毒性持续时间更长。此外,CD28相关的ICAHT通常更严重,3级或4级ICAHT的发生率更高。
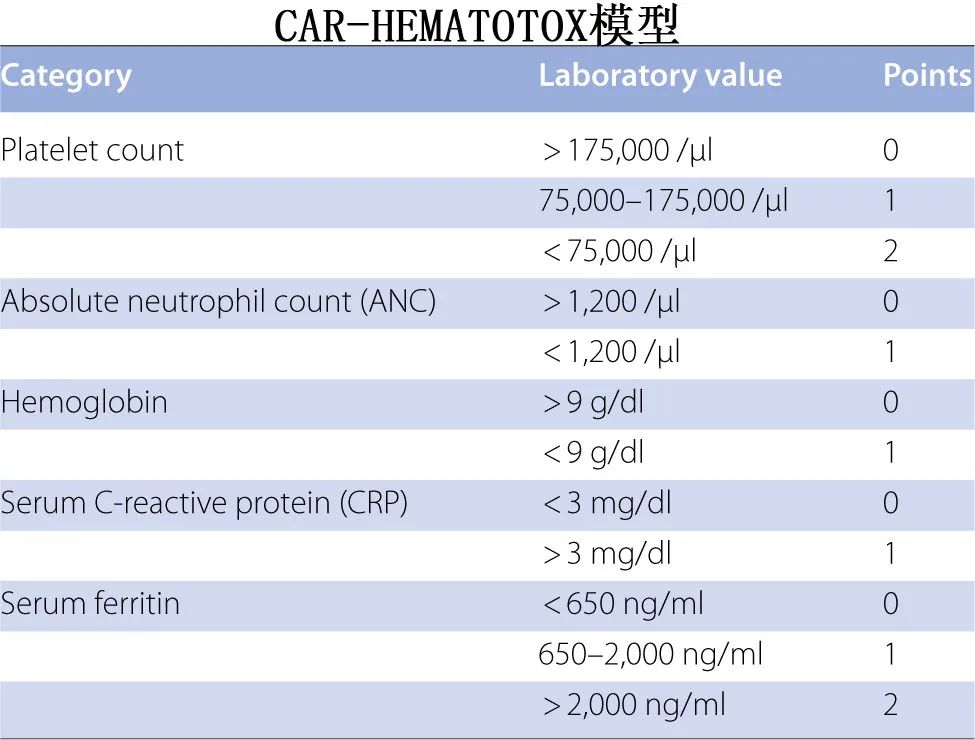
CAR-HEMATOTOX模型重点关注造血储备(如血小板计数、血红蛋白、绝对中性粒细胞计数[ANC](>或< 1200/μL))和基线炎症,以评估CAR-T治疗后迟发性血细胞减少的风险;强调了骨髓储备和治疗前炎症在管理ICAHT风险中的重要性。此外,肿瘤坏死因子(TNF)-α和CRP与ICAHT的早期发病有关,强调了临床医生在治疗决策中评估因果关系、时间和严重程度的必要性。
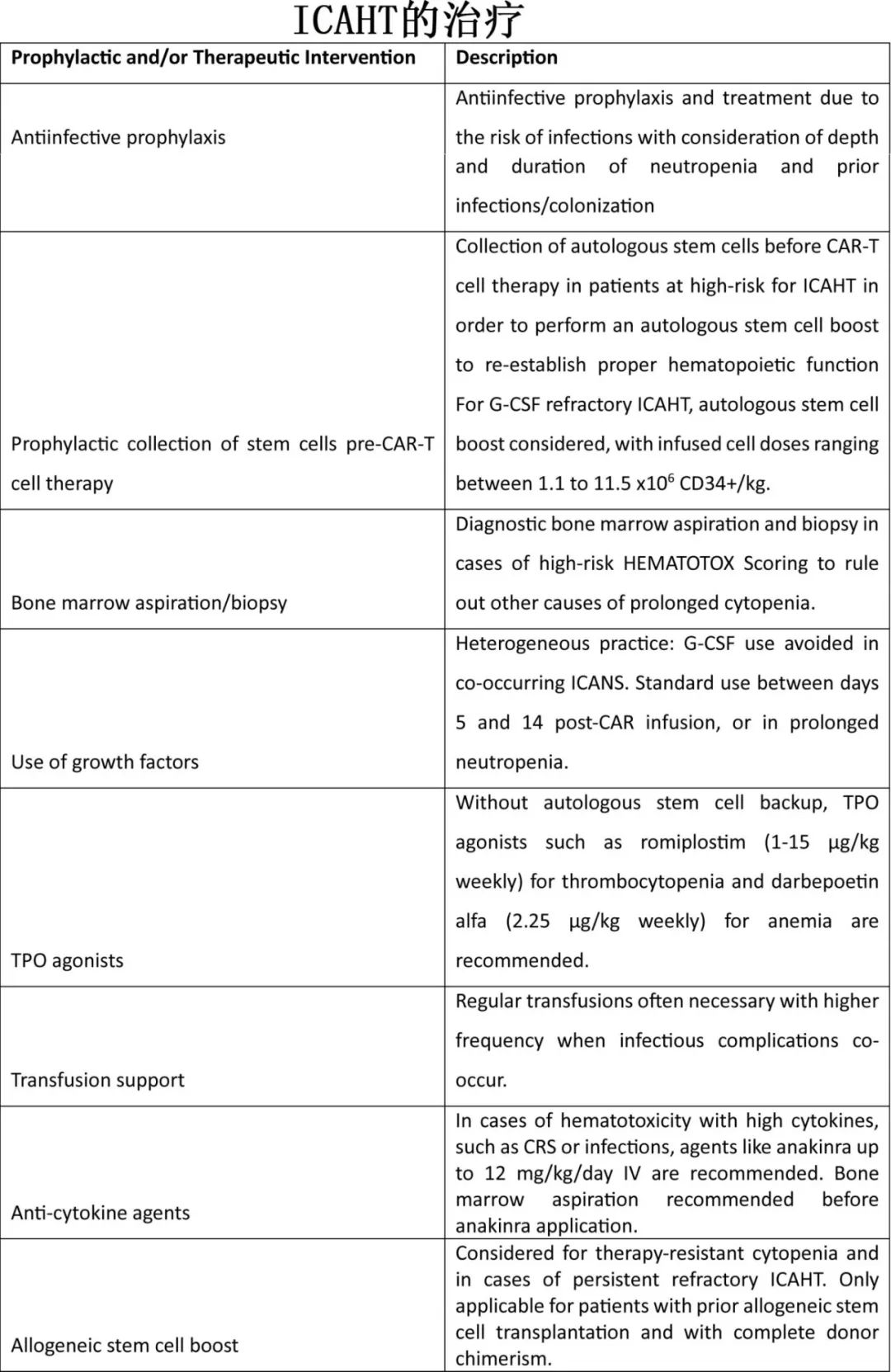
ICAHT的治疗
感染是ICAHT的重大不良事件,亟需抗感染预防。一项调查显示在处理高危HEMATOTOX评分方面存在差异,部分中心提倡预防性骨髓穿刺或活检。然而预防性使用粒细胞集落刺激因子(G-CSF)会增加≥2级CRS,从而限制将其作为ICAHT的治疗选择。生长因子是ICAHT期间最常见的治疗方法,自体干细胞增强(autologous stem cell boosts)是G-CSF难治性患者的首选替代方案,输注细胞剂量范围为1.1-11.5 × 106 CD34+ /kg。在没有干细胞备份的情况下首选TPO激动剂,剂量为每周1至15 μg/kg。对于贫血,每周2.25 μg/kg起始剂量的darbepoetin alfa(红细胞生成刺激剂)是可选项,但通常需要输血。早期自体干细胞增强可以提高一年生存率,但受到长期中性粒细胞减少的负面影响。考虑对血液毒性高危患者采用脉冲给药糖皮质激素治疗和预防性自体干细胞采集,采集目标为1~1.5 × 106 CD34+细胞/kg。如果血液毒性可能与大量细胞因子有关,如CRS或感染,也应考虑使用IL-1受体拮抗剂anakinra。由于在CAR-T细胞治疗相关ICAHT的情况下,anakinra没有明确的推荐剂量,因此类似于难治性CRS/ICANS的推荐剂量,可选最高12mg /kg/d IV。临床医生应密切监测ICAHT分级,考虑早期使用G-CSF,筛查病毒血症并排除HLH。对于治疗耐药的ICAHT,异基因HCT是最强的治疗措施,但会消除CAR-T细胞。
低丙种球蛋白血症和感染
低丙种球蛋白血症(HGGA)是CAR-T细胞治疗后一种重要的免疫并发症,定义为IgG<700 mg/dL, IgA<70 mg/dL和IgM<40 mg/dL。在治疗后的最初90天内,高达67%的患者可能发生HGGA。CAR-T细胞持续存在表明持续活性,但可导致持续性HGGA;导致B细胞发育不全和随后的HGGA的其他因素包括全身性炎症、CRS等并发症、CAR-T前清淋和先前免疫化疗诱导的B细胞毒性。缺乏统一的HGGA定义使CAR-T后的发病率评估复杂化,但CAR-T治疗与HGGA之间的直接关联已得到充分证明。
不同CAR-T产品的HGGA率各不相同。年龄对HGGA发生率有显著影响,由于免疫球蛋白亚类发育较晚和浆细胞成熟,儿童患者的发病率高于成人或青少年。HGGA患者可能需要免疫球蛋白替代治疗,建议每3周0.2-0.4 g/kg,但由于潜在的较高免疫球蛋白消耗,重症监护下可能需要更频繁的替代治疗。防止IgG水平降至450 mg/dL以下至关重要,各种多价免疫球蛋白在功效上基本相同。应根据绝对ANC考虑抗病毒、抗真菌和抗生素预防,特别是中性粒细胞减少持续超过7天的情况下。相关建议包括阿昔洛韦、复方新诺明预防PCP、氟康唑抗真菌预防和环丙沙星抗生素预防,发热情况下迅速增加抗生素非常重要,以覆盖广泛的病原体。
CAR-T治疗后的感染会由于HGGA和清淋化疗导致的体液和细胞免疫反应受损而加剧,在前10天内达到高峰。高达42%的感染报告发生于第一个月,约21%发生于第29天至第90天之间。感染与HGGA严重程度和CRS相关,一项荟萃分析报告34%的严重感染率,主要是呼吸道感染。有荚膜的细菌,如肺炎链球菌和流感嗜血杆菌,在这种情况下尤为严重。23-34%的患者发生严重感染。感染性并发症的危险因素与血液毒性和/或HGGA的危险因素重叠,包括既往异基因HCT、治疗前多线免疫化疗(>3线)、清淋治疗前基线中性粒细胞减少(ANC< 500/μL),以及抗IL-6-R药物和皮质类固醇。
噬血细胞性淋巴组织细胞增多症
噬血细胞性淋巴组织细胞增多症(HLH)和巨噬细胞活化综合征(MAS)是CAR-T细胞治疗可能引发的炎症。虽然全面的HLH很少见,但导致血液毒性的HLH样症状更为常见。CRS进展可通过过度细胞因子释放激活T细胞和巨噬细胞,从而导致HLH/MAS。CAR-T细胞的过度活化加剧了这种情况,造成了免疫失调的循环。此外,对免疫平衡至关重要的调节性T细胞功能受损,可进一步促进HLH/MAS的发展。为了区分HLH/ MAS与感染,必须满足特定的诊断标准,需要以下8个因素中的至少5个:发热、脾肿大、≥2个成分血细胞减少、高甘油三酯血症和/或低纤维蛋白原血症、铁蛋白升高、sCD25升高、NK细胞活性降低以及骨髓、脑脊液或淋巴结噬血细胞增多。
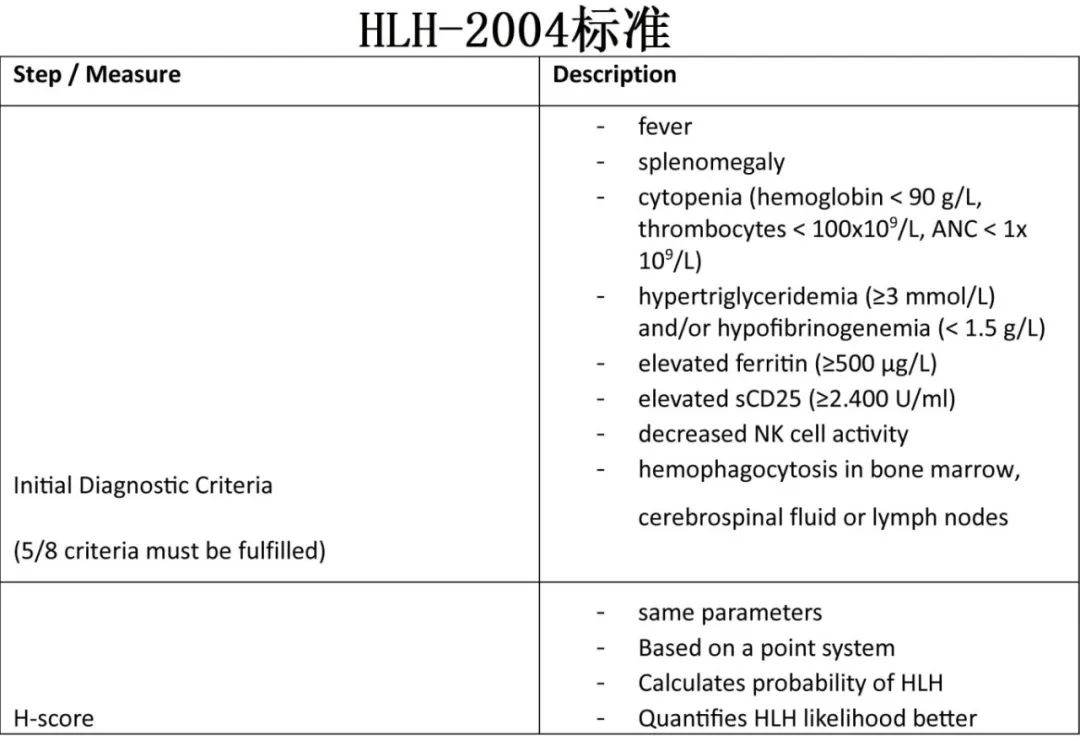
经典的HLH/MAS治疗包括免疫抑制,从大剂量皮质类固醇开始,如地塞米松,联合环孢素a。在CAR-T诱导的HLH/MAS中,建议使用抗细胞因子药物如IL-6-R抑制剂托珠单抗,对于严重病例推荐使用anakinra。初始治疗通常包括托珠单抗,也可联合皮质类固醇。
如果免疫抑制治疗不足,可以考虑使用环孢素A、依托泊苷或环磷酰胺等药物,但后两者会损害甚至清除CAR-T细胞治疗。免疫调节剂如alemtuzumab或抗胸腺细胞球蛋白可能是难治性病例的选择。支持性护理包括监测生命体征、器官功能和管理并发症,对患者管理至关重要。
器官毒性
根据靶抗原表达谱,CAR-T细胞疗法可导致特定器官的损伤。例如,如果目标抗原在肺组织中表达,患者可能出现肺毒性,表现为呼吸困难、咳嗽和影像学上的浸润。同样,如果靶抗原在肝脏中表达,则可能发生肝毒性,导致肝酶升高和肝功能障碍。
心脏毒性
心脏毒性是CAR-T细胞治疗后的器官特异性副作用,发生率为10%至36%。它涉及多种病理生理机制,包括IFN-γ刺激巨噬细胞引起的CRS损伤,导致IL-6释放,从而损害心脏微循环,加重灌注。在宏观层面上,IL-6过度激活可引起与CRS相关的容量耗损,降低心脏预负荷,导致左室射血分数降低、心律失常和心电图上ST段改变,特别是在已有心脏疾病的患者中。CAR-T细胞相关心脏毒性的临床治疗类似心脏症状的治疗,包括使用托珠单抗以8 mg/kg的剂量阻断IL-6-R,类似于CRS治疗。在ICU,注意心律失常、最佳容积、电解质和抗炎管理至关重要。
参考文献
Schroeder T, et al. Management of chimeric antigen receptor T (CAR‑T) cell‑associated toxicities.Intensive Care Med . 2024 Aug 22. doi: 10.1007/s00134-024-07576-4.


