临床研究|我国部分地区慢性HBV感染者HDV感染情况调查
时间:2023-07-27 21:23:06 热度:37.1℃ 作者:网络
丁型肝炎病毒(HDV) 是δ病毒科δ病毒属的唯一成员,是一种缺陷病毒,需要乙型肝炎表面抗原(HBsAg) 参与才能复制和组装成完整病毒体[1]。HDV通过与HBV相同的钠离子-牛磺胆酸共转运多肽(NTCP) 受体进入肝细胞[2]。虽然HDV从发现至今已40余年,但科学界和公众对其关注有限[3]。我国1992年和1996年的HDV流行率调查结果显示,HBsAg携带者HDV抗体流行率分别为1.15%和1.46%[4-5]。
此后,我国暂无全国性的HDV流行情况调查数据。近年来,多篇系统综述[6-7]研究结果显示,我国HBsAg携带者HDV抗体流行率为2.1%~5.57%,远高于早期报道结果。HBV感染者感染HDV表现为HBV/HDV联合感染和重叠感染2种形式[8]。有研究[9]认为,慢性丁型肝炎是导致终末期肝病的重要原因,70%的慢性丁型肝炎患者在确诊后5~10年可进展为肝硬化,15%的患者仅需1~2年即可进展为肝硬化[10]。与HBV单独感染者相比,HBV/HDV合并感染者肝细胞癌(HCC) 发生风险与死亡风险更高(OR值分别为1.97、2.05)[11]。
另外,对于慢性乙型肝炎、乙型肝炎相关肝硬化和乙型肝炎相关肝癌患者,其感染HDV的风险分别是无症状HBsAg携带者的3.56倍、6.75倍和5.61倍[11]。目前我国为HBV中度流行国家,约有7 000万慢性HBV感染者,其中慢性乙型肝炎患者2 000万~3 000万,HBV相关肝硬化和HCC患者分别为100万和30万[12]。因此,有必要对HBV感染者的HDV感染情况进行筛查,以利于指导患者的临床管理和治疗。刘慧敏等[13]发现,近10年间,我国西南医院HBsAg阳性患者的HDV筛查率仅1.6% (13 585/832 144),建议加大筛查力度,重视丁型肝炎。由于系统综述研究结果差异大,大样本的真实世界研究开展少,所以目前我国HDV的真实流行情况仍未知。本研究对我国10个省市自治区12家医院收集的慢性HBV感染者血清标本进行检测,了解我国不同地区HBV感染者的HDV感染流行情况。
1、资料与方法
1.1 研究对象
2021年3月—2022年6月,从全国10个省、自治区和直辖市的12家医院共收集HBsAg阳性慢性HBV感染者(包括HBsAg阳性携带者、慢性乙型肝炎患者、乙型肝炎肝硬化患者和乙型肝炎肝癌患者) 血清3 131例,其中赤峰市传染病防治医院500例,内蒙古国际蒙医医院300例,呼和浩特市第二医院86例,哈尔滨医科大学附属四院400例,吉林市传染病医院100例,北京市佑安医院708例,中南大学湘雅二医院200例,广西医科大学第一附属医院203例,安徽省立医院217例,新疆维吾尔自治区中医医院226例,西安交通大学第一附属医院135例,成都市公共卫生临床医疗中心56例。血清标本采集后于-20 ℃冰箱保存,通过冷链运输至北京大学医学部病原生物系实验室。HBsAg阳性携带状态、慢性乙型肝炎、乙型肝炎肝硬化的诊断参照《慢性乙型肝炎防治指南(2019年版) 》[14],乙型肝炎肝癌的诊断参照《原发性肝癌诊疗规范(2019年版) 》[15]。同时,收集患者的基本人口学信息,以及乙型肝炎血清学指标5项、HBV DNA、肝功能、HCV和HIV检测结果等。
1.2 抗-HDV IgG检测
应用万泰抗-HDV IgG试剂检测全部3 131例血清标本,其中500例血清标本并用贝尔抗-HDV IgG试剂检测(包括来自内蒙古标本450例、北京30例、湖南20例,其中含有全部万泰试剂检出抗-HDV IgG阳性标本),2种试剂均获得北京食品药品监督管理局批准。严格按照各厂家说明书进行操作。任一试剂检测结果呈阳性即认为该标本抗-HDV IgG阳性。
1.3 HDV RNA检测
采用德国Qiagen公司“QIAamp Viral RNA Mini Kit”对抗-HDV IgG阳性标本进行HDV RNA提取。应用巢式逆转录聚合酶链式反应(nRT-PCR) 扩增部分HDV基因序列,先采用赛默飞世尔公司逆转录试剂“RevertAid First Strand cDNA Synthesis Kit”将HDV RNA转录为cDNA;然后采用翌圣生物科技公司“Hieff CanaceⓇ Gold High Fidelity DNA Polymerase高保真DNA聚合酶”进行nRT-PCR反应。严格按试剂说明书进行操作。nRT-PCR引物见参考文献[16],第一轮引物序列为:HDV-819 (5′-TCC CTT AGC CAT CCG AGT GGA C-3′) 和HDV-1303 (5′-AGG GTT CAC CGA CAA GGA GAG G-3′)。第二轮引物序列为:HDV-856 (5′-GGA TGC CCA GGT CGG ACC G-3′) 和HDV-1282 (5′-AAG GAA GGC CCT CGA GAA CAA G-3′)。引物由上海生工生物工程股份有限公司合成。
1.4 HDV基因型检测
将抗-HDV IgG阳性标本的nRT-PCR产物送至上海生工生物工程股份有限公司进行序列测定。采用Bioedit软件对测序结果进行预处理;从NCBI GenBank数据库下载8个HDV基因型的参考序列(见参考文献[17]),采用MEGA 7.0软件构建基于邻位连接法的系统发育树进行基因型分析。
2、结果
2.1 慢性HBV感染者抗-HDV IgG阳性率
本研究共采集到3 131例慢性HBV感染者血清,共检出抗-HDV IgG阳性血清标本22例(0.70%),其中内蒙古自治区886例标本检出抗-HDV IgG阳性标本16例(1.81%);北京市708例标本检出2例(0.28%);湖南省200例标本检出2例(1.00%);新疆维吾尔自治区226例标本检出2例(0.88%),其余省市自治区均未检出抗-HDV IgG阳性标本。慢性HBV感染者的抗-HDV IgG阳性率及地理分布见图1。经χ2检验,内蒙古自治区的抗-HDV IgG阳性率显著高于北京市 (P=0.004) 和其他地区(除内蒙古外的其余9个地区) (P<0.001),其余地区间抗-HDV IgG阳性率比较均无显著差异(P值均>0.05)。
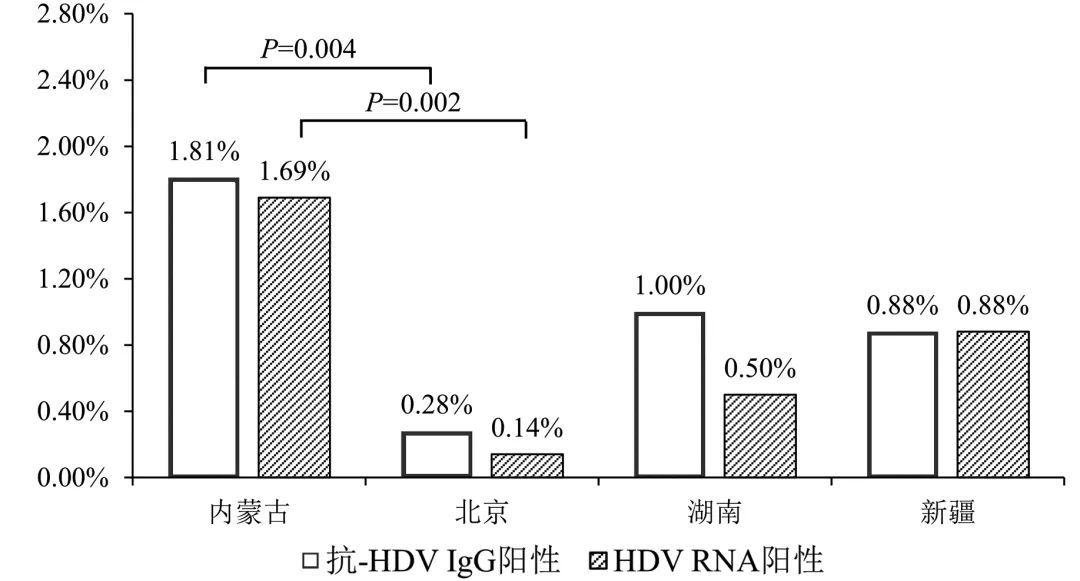
图1 我国部分地区慢性HBV感染者HDV感染流行率
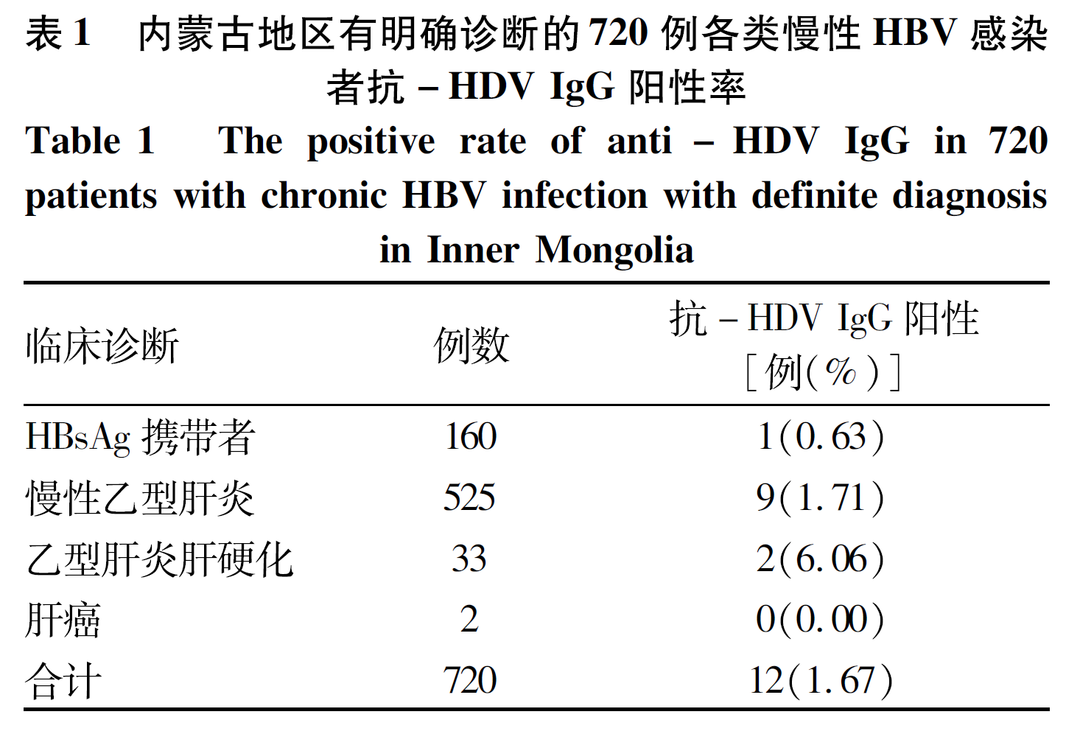
对各类慢性HBV感染者分层分析,发现内蒙古地区的慢性乙型肝炎患者和乙型肝炎肝硬化患者抗-HDV IgG阳性率显著高于其他地区[慢性乙型肝炎: 1.71% (9/525) vs 0.31% (4/1 298), P=0.003; 乙型肝炎肝硬化: 6.06% (2/33) vs 0.23% (1/437), P=0.014]。对内蒙古地区有明确诊断的720例各类慢性HBV感染者的抗-HDV IgG阳性率比较,发现HBsAg携带者、慢性乙型肝炎患者和乙型肝炎肝硬化患者的抗-HDV IgG阳性率逐渐升高,分别为0.63% (1/160)、1.71% (9/525)和6.06% (2/33),但各类型患者的抗-HDV IgG阳性率比较无显著差异(P值均>0.05),2例乙型肝炎肝癌患者抗-HDV IgG均阴性(表1)。其他地区(除内蒙古外的其余9个地区)抗-HDV IgG阳性患者较少(5例),有明确诊断的2 106例慢性HBV感染者中,各类患者的抗-HDV IgG阳性率比较均无显著差异(P>0.05)。
2.2 抗-HDV IgG阳性标本HDV RNA检测
22例抗-HDV IgG阳性标本经nRT-PCR检测,有19例HDV RNA阳性,内蒙古自治区标本HDV RNA阳性率为1.69% (15/886),北京市标本为0.14% (1/708),湖南省标本为0.50% (1/200),新疆维吾尔自治区标本为0.88% (2/226)。各省市自治区HDV RNA阳性标本检出情况见图1。内蒙古自治区标本HDV RNA阳性率明显高于北京市(P=0.002) 和其他地区(除内蒙古外的其余9个地区) (P<0.001)。对19例HDV RNA阳性标本进行序列测定,利用MEGA 7.0软件构建基于邻位连接法的系统发育树,结果显示,19条HDV序列均与HDV-1型聚类成簇,属于HDV基因1型。
2.3 HDV感染者临床特征分析
2.3.1 总体HDV感染者临床特征分析
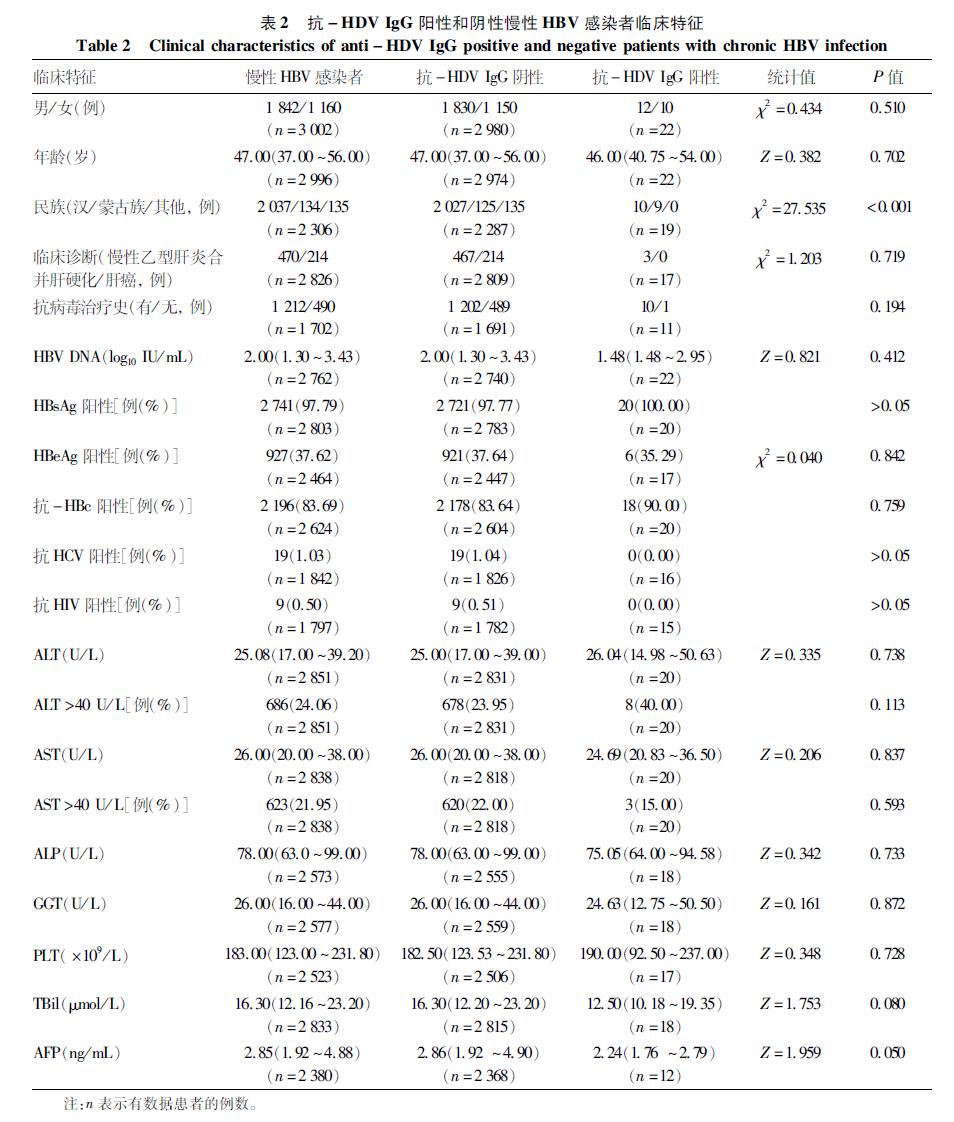
根据抗-HDV IgG检测结果,对慢性HBV感染者的临床特征进行统计分析,因部分患者临床信息缺失,在表2中已标出每项检查有数据患者的例数(n)。3 131例患者中,抗-HDV IgG阳性22例,阴性3 109例。抗-HDV IgG阳性组与阴性组的年龄及性别差异均无统计学意义(P值均>0.05)。研究共采集到1 702例患者的抗病毒治疗史信息,其中71.21% (1 212/1 702) 进行过抗病毒治疗,抗-HDV IgG阳性组抗病毒治疗率为90.91%(10/11),阴性组为71.08%(1 202/1 691);同时阳性组HBV DNA为1.48 (1.48 ~ 2.95) log10 IU/mL,阴性组为2.00 (1.30 ~ 3.43) log10 IU/mL,组间差异均无统计学意义(P值均>0.05)。共收集到2 826例患者的临床诊断信息,诊断为乙型肝炎相关肝硬化/肝癌患者共684例,其中抗-HDV IgG阴性组681例,抗-HDV IgG阳性组3例,两组比较无统计学差异(P>0.05)。根据慢性HBV感染者民族信息分为汉族、蒙古族和其他少数民族,经Fisher精确检验,抗-HDV IgG阳性组蒙古族患者的比例(47.37%, 9/19) 明显高于抗-HDV IgG阴性组(5.47%, 125/2 287) (P<0.001)。其余指标(如HBV感染相关指标、肝功能指标) 在两组间的比较均无统计学差异(P值均>0.05)。
2.3.2 内蒙古自治区HDV感染者临床特征分析
本研究检测出的抗-HDV IgG阳性患者主要来自内蒙古地区,所以对内蒙古地区抗-HDV IgG阳性和阴性慢性HBV感染者的临床特征进行比较分析。本研究共采集到内蒙古自治区慢性HBV感染者血清886例,抗-HDV IgG阳性组16例,阴性组870例,性别和年龄在两组间比较无统计学差异(P值均>0.05)。抗-HDV IgG阳性组蒙古族患者占比60.00%(9/15)、ALT异常(ALT>40 U/L) 患者占比57.14%(8/14)、进行过抗病毒治疗患者占比87.50%(7/8),均显著高于阴性组(P值均<0.05)。而抗-HDV IgG阳性组患者的HBV DNA水平中位数[1.90(1.48~3.07) log10 IU/mL] 显著低于阴性组[2.85(1.48~5.00) log10 IU/mL, P=0.030](图2)。其余指标如AST、ALP、GGT、HBsAg、HBeAg等在抗-HDV IgG阳性和阴性组间均无显著差异(P值均>0.05)。
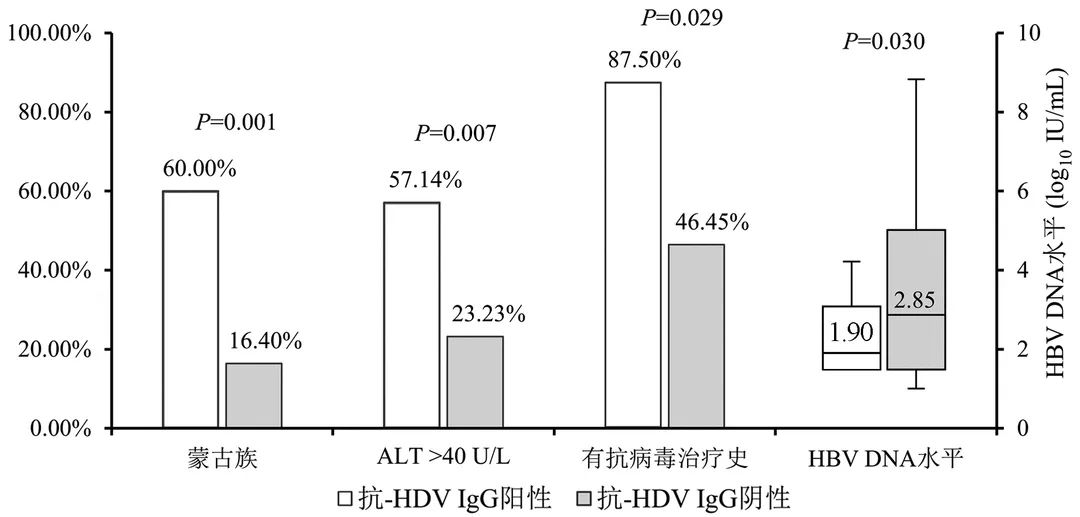
图2 内蒙古地区抗-HDV IgG阳性和阴性慢性HBV感染者临床特征比较
3、讨论
HDV通过HBV/HDV联合感染或重叠感染2种形式导致急性或慢性丁性肝炎,加速乙型肝炎患者的疾病进展[18]。7%~14%的HBV/HDV重叠感染者或2%~3%的HBV/HDV联合感染者可发展为重症肝炎,90%的HBV/HDV重叠感染者或2%~5%的HBV/HDV联合感染者可转为慢性丁型肝炎[19]。慢性丁型肝炎是最严重形式的病毒性肝炎,且疾病进展迅速[20]。由于丁型肝炎无特异性疾病表现,若未进行HDV检测,难以区分单纯乙型肝炎和HBV/HDV联合或重叠感染,因此,有必要对HBV感染者进行HDV感染筛查,使HBV感染者知晓自己的HDV感染情况,有利于丁型肝炎患者的进一步临床管理和治疗。
目前,无论是欧美国家还是我国的HDV筛查率均较低,这也是很多国家无法获得准确HDV流行病学数据的原因之一[13, 21-22]。一些国际指南[23-25]建议对所有慢性HBV感染者或有HDV感染风险因素的HBsAg阳性患者进行HDV感染筛查。当下,丁型肝炎治疗药物研发已取得很大进展,HDV进入抑制剂——Hepcludex于2020年7月获得欧洲药品管理局有条件批准上市,用于治疗血浆(或血清) HDV RNA阳性的代偿期成人慢性丁型肝炎,其他靶点抗HDV治疗药物的临床试验也在推进[26]。因此,及时掌握HDV感染流行情况,识别HDV感染者,可使患者尽早纳入临床管理,控制病情发展,减少终末期肝病发生,也有利于实现世界卫生组织提出的2030年消除病毒性肝炎公共卫生危害的目标[3]。
系统综述研究[6-7]结果提示,我国HBsAg携带者HDV抗体流行率有所上升,但不同研究结果差异较大,我国现阶段真实的HDV感染流行情况仍需进一步研究。Roggenbach等[27]收集了我国11个省市自治区的3 065例HBsAg阳性患者血清,对HDV流行情况进行分析,结果显示,内蒙古自治区和新疆维吾尔自治区HDV流行率偏高,分别为13.9%和3.9%,其余9个省市未检出HDV抗体阳性标本。王彦[28]对我国7个省市自治区的3 000例慢性乙型肝炎患者进行HDV流行情况调查,发现单独慢性乙型肝炎患者的HDV流行率为0.85%,HIV/HBV合并感染者的HDV流行率为7.91%,四川省(13.88%) 和广西壮族自治区(5.32%) HDV流行率偏高,与纳入研究的HIV/HBV合并感染者比例高有关。
本研究对来自全国10个省市自治区的3 131例慢性HBV感染者进行HDV感染情况调查,发现内蒙古自治区、北京市、湖南省和新疆维吾尔自治区慢性HBV感染者的抗- HDV IgG阳性率分别为1.81%(16/886)、0.28%(2/708)、1.00%(2/200)和0.88%(2/226),其余地区未检出,总体抗-HDV IgG阳性率为0.70%(22/3 131)。内蒙古自治区慢性HBV感染者抗-HDV IgG阳性率较高,并且蒙古族患者阳性率显著高于汉族和其他民族,其原因可能与民族习惯有关,蒙古族使用刀具的机会较多,这可能会使当地人感染血源性传播疾病的可能性增加,导致HDV流行率较高;也可能与地理位置毗邻HDV高流行区(蒙古国) 有关[27]。王彦[28]研究报道,少数民族(以彝族为主) HDV感染者的比例也明显高于汉族。以上研究结果提示,HDV在我国处于低流行态势,不同地区HDV流行率差异大,高风险人群的HDV流行率高。不同研究对同一地区筛查得出的HDV流行率存在差别,可能与研究的地理区域、纳入研究的人群类别及使用的HDV抗体检测试剂不同有关。
另外,本研究在内蒙古地区慢性HBV感染者中发现,HBV/HDV合并感染者接受抗病毒治疗比例高、HBV DNA水平显著低于HBV单独感染者,而ALT异常患者比例显著高于HBV单独感染者。Jang等[29]发现与单独慢性乙型肝炎患者相比,合并HDV感染的患者在抗HBV治疗1年和2年后ALT异常的风险分别增加30倍和10倍。既往研究[28, 30-31]也发现,HDV感染可抑制HBV复制或HBeAg表达,HDV感染者ALT水平反复波动,ALT异常患者比例更高,可能与HDV感染后进一步加重乙型肝炎患者肝损伤有关。因此,建议对抗病毒治疗后无生化学应答的慢性乙型肝炎患者,尤其是HBV DNA低水平患者,进行HDV感染相关检查。但Liao等[32]发现,对慢性乙型肝炎患者,HDV感染者的HBV DNA水平明显低于HBV单独感染者;而对终末期肝病患者,HDV感染者的HBV DNA水平却明显较高,可能提示HDV抑制HBV复制与肝病进展情况有关。
本研究存在一些不足之处。由于本研究为多中心研究,各医院开展的检测项目有差异,收集的临床资料不够完善,部分患者检测项目信息缺失,给临床数据分析造成影响。其次,本研究中大部分患者都接受过乙型肝炎抗病毒治疗,重症肝病患者比例少,可能会影响HDV流行率的估计。除用于治疗乙型肝炎外,聚乙二醇干扰素(PEG-IFNα) 是目前国外指南唯一推荐用于治疗丁型肝炎的药物,持续病毒学应答率为20%~30%[10, 33]。因此,对于使用PEG-IFNα治疗的乙型肝炎患者,若合并HDV感染,也有一定治疗效果。核苷(酸) 类似物是另一类用于治疗乙型肝炎的药物,虽然对丁型肝炎无治疗效果或效果甚微,但可有效控制乙型肝炎患者的病情进展[34]。研究[35]认为,HDV抗体阳性率随肝病严重程度而明显增加,在轻症肝病患者中发现HDV抗体阳性患者的概率小。
另外,本研究未招募到高风险人群(如HIV、HCV感染者,静脉吸毒者,高风险性行为者等),而有研究[6]发现,这部分人群的HDV感染率显著高于普通HBV感染者。
综上所述,本研究中3131例慢性HBV感染者的HDV IgG抗体流行率为0.70% (22/3 131),不同地区HDV流行率差异大,内蒙古自治区抗-HDV IgG抗体阳性率(1.81%) 相对较高。HDV RNA阳性感染者的HDV基因型均为1型。本研究发现我国部分地区HDV流行率较低,但考虑到HDV流行的地区差异、人群差异和HDV感染后的疾病特点,建议对重点地区和高风险人群加大HDV筛查力度,使丁型肝炎患者能获得及时有效治疗;在开展全国乙型肝炎血清流行病学调查时,对HBsAg阳性人群检测抗-HDV IgG,了解我国一般人群的抗-HDV IgG流行率。
全文下载
刘玉梅, 郭小平, 张慧敏, 等. 我国部分地区慢性HBV感染者HDV感染情况调查[J]. 临床肝胆病杂志, 2023, 39(4): 795-803.


