STTT 四川大学华西医院郭应强/秦超毅教授团队发现中性粒细胞外陷阱与心肌细胞相互作用促进房颤进展
时间:2023-07-31 23:23:21 热度:37.1℃ 作者:网络
心房颤动(房颤)是一种常见的心律失常,以心房快速、不规则地搏动为特征。心功能障碍及血栓导致的卒中是房颤最常见的并发症,尤其是卒中因其高致残率及病死率,严重增加社会经济负担。目前,炎症和纤维化被认为是房颤发生发展中的主要病理变化,但其发病机制尚未完全阐明。
房颤的发生发展与炎症反应及免疫细胞活化密切相关。过去认为,中性粒细胞的主要作用是在急性炎症反应中消除致病菌和损伤细胞。然而,近期研究表明,中性粒细胞可以分泌中性粒细胞外陷阱(neutrophil extracellular traps, NETs),参与慢性阻塞性肺病、动脉粥样硬化、肝炎及其他慢性非感染性疾病。但是,NETs在房颤中的作用目前尚不清楚。NETs是指由中性粒细胞释放的一种细胞外网状结构,其DNA骨架包含核和线粒体DNA,支撑着丰富的中性粒细胞颗粒和细胞质蛋白。有研究表明,急性心肌梗死后,NETs通过激活Smad和MAPK信号通路促进心肌病理性纤维化及室壁瘤形成。由于心肌纤维化与房颤的发生密切相关,因此,NETs很有可能参与了房颤的发生发展。
2023年7月26日,四川大学华西医院郭应强/秦超毅教授团队在Signal Transduction and Targeted Therapy发表了题为“Interaction between neutrophil extracellular traps and cardiomyocytes contributes to atrial fibrillation progression”的研究论文,揭示了房颤中NETs的形成机制,阐明了NETs与心肌细胞间的相互作用在房颤中的作用及机制。

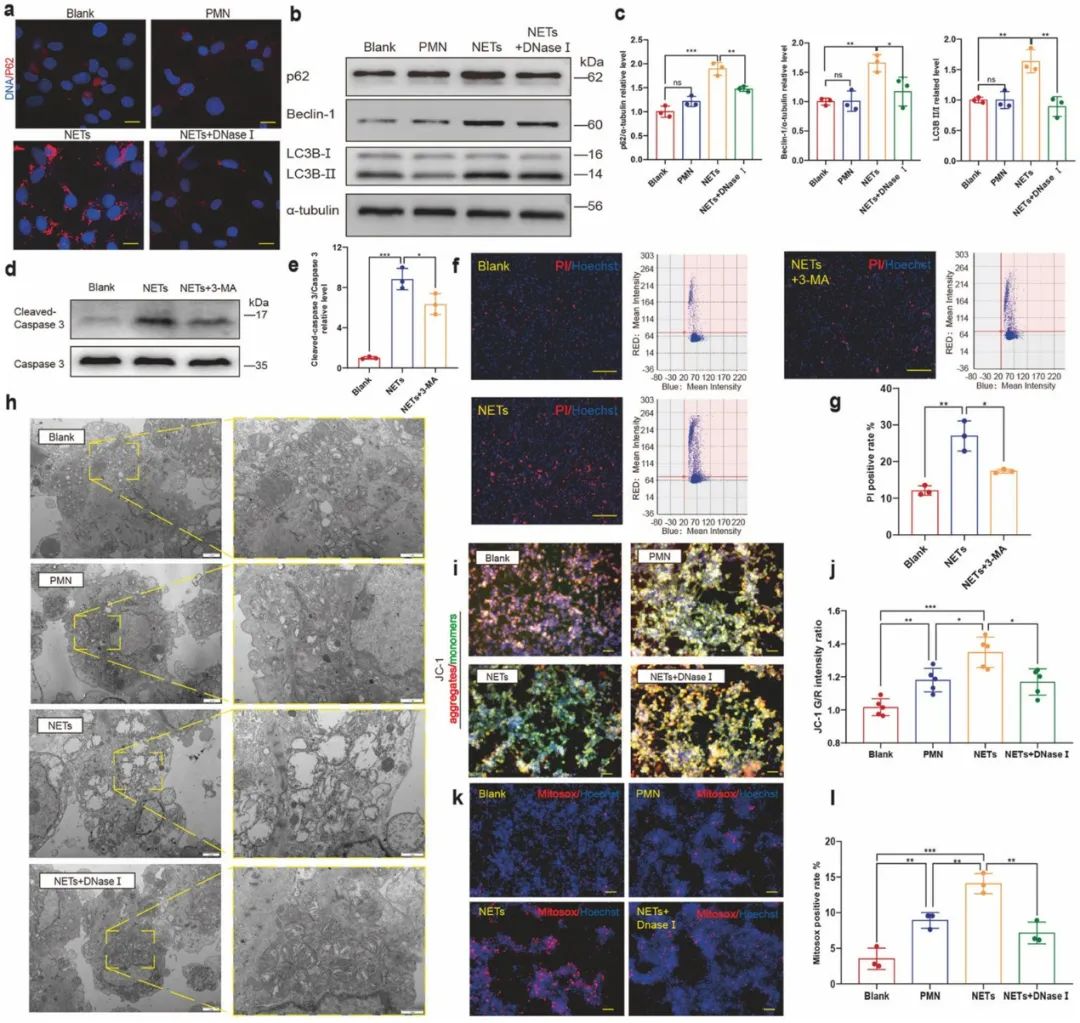
首先,该研究发现,与窦性心律患者相比,房颤患者外周血及左心耳匀浆的NETs含量显著升高,并且NETs主要在左心耳和冠状血管中形成。体外实验结果显示,与NETs孵育后,心肌细胞核凋亡明显增多,而能降解NETs的DNase I可以抑制NETs促心肌细胞凋亡作用。并且,与NETs孵育后,心肌细胞的p62和Beclin-1水平增加,而自噬抑制剂3-MA抑制了NETs诱导的心肌细胞凋亡,这说明NETs通过自噬途径促进心肌细胞凋亡。由于线粒体对心肌细胞收缩的能量供应至关重要,而功能失调的线粒体产生过多的活性氧(ROS)可能会促进细胞死亡,因此研究人员分析了NETs对心肌细胞线粒体的影响。结果表明,NETs可引起心肌细胞中线粒体肿胀、线粒体膜电位去极化及线粒体ROS产生增多。以上结果说明,NETs对心肌细胞具有细胞毒性作用。
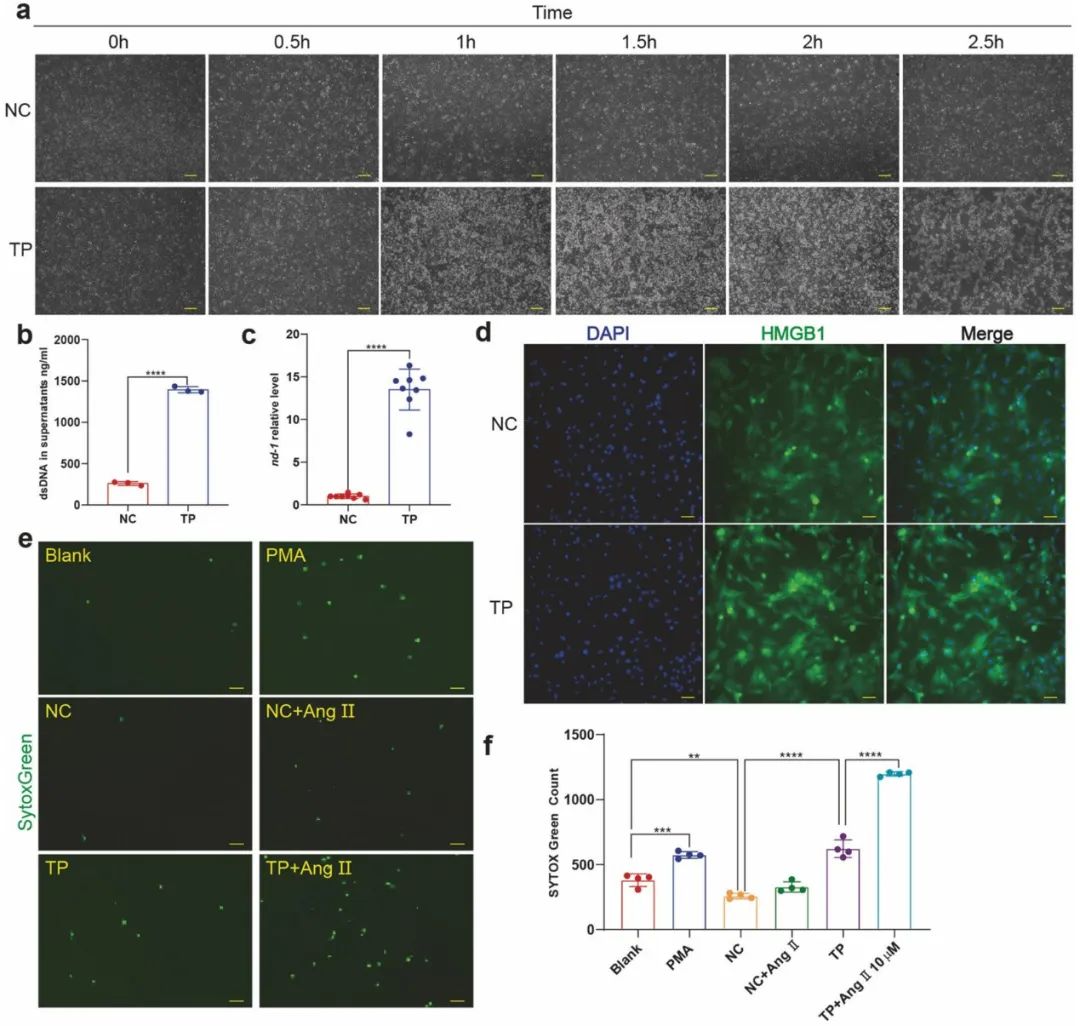
接下来,研究人员探究了房颤中NETs产生的机制。房颤患者外周血的Ang II含量显著升高,但是给予中性粒细胞单独Ang II刺激并不能引起NETs生成增多以及NETs诱导的细胞毒性作用。PMA可以引起中性粒细胞强烈活化,Ang II可以协同PMA间接促进NETs生成。研究人员给予心肌细胞快速起搏刺激构建房颤细胞模型,发现心肌的快速起搏导致线粒体DNA水平升高及HMGB1从细胞核到细胞质的转位,HMGB1可介导NETs引起的细胞毒性作用。并且,利用快速起搏的心肌细胞上清孵育中性粒细胞,中性粒细胞分泌NETs显著增多,显示出与PMA类似的作用,而正常起搏速率的心肌细胞上清则可以抑制中性粒细胞产生NETs。
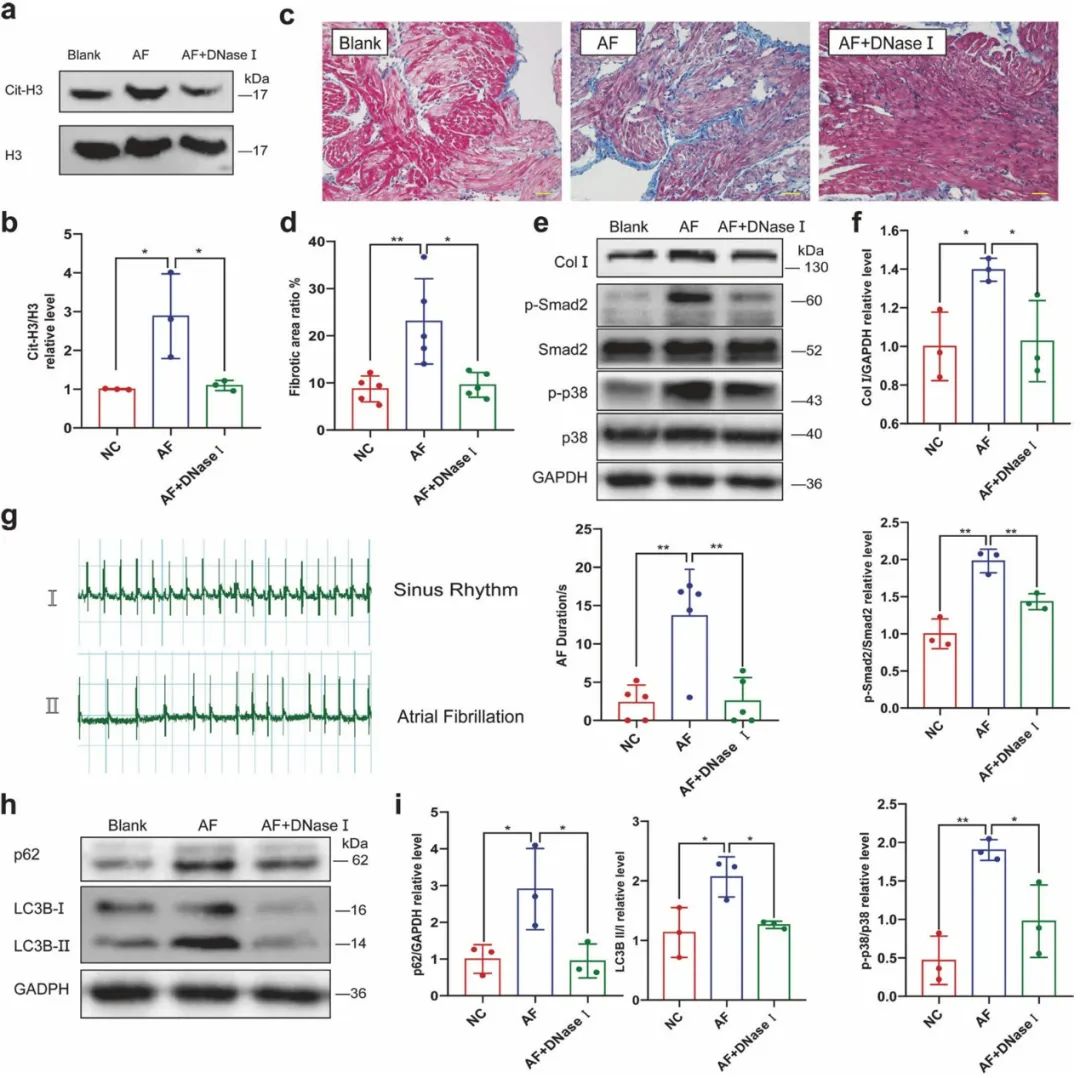
最后,研究人员在体内验证了可下调NETs含量的DNase I对房颤是否具有保护作用。结果显示,DNase I抑制了房颤大鼠左心房的胶原沉积增加及p-Smad2、p-p38水平的升高,还抑制了房颤大鼠心房组织自噬水平的上调,并有效降低了大鼠房颤的发生率和持续时间。
综上所述,本研究发现,房颤患者外周血NETs水平显著升高,而NETs诱导了心肌细胞自噬性凋亡,并通过促进线粒体去极化和ROS的产生导致线粒体损伤。持续的过速起搏导致心肌细胞损伤,为诱导中性粒细胞分泌NETs提供了有利的刺激。同时,房颤中升高的Ang II与心肌细胞损伤产生的刺激协同增加了NETs的生成及NET诱导的细胞毒性作用。该研究揭示了房颤中NETs的形成机制,阐明了由NETs和心肌细胞分泌的刺激组成的正反馈促进心脏纤维化及房颤进展的机制。
原文链接:
https://www.nature.com/articles/s41392-023-01497-2


