Nat Biotech:黄力夫教授团队发现杀伤肿瘤相关细菌也能引发抗肿瘤免疫反应
时间:2023-09-28 08:21:33 热度:37.1℃ 作者:网络
细菌与肿瘤免疫
建立针对癌症衍生表位的免疫反应已成为癌症免疫治疗的支柱。释放T细胞免疫以引发抗肿瘤免疫反应已大幅推动了抗肿瘤的临床进展,包括检查点抑制剂、癌症疫苗和嵌合抗原受体T细胞(CAR-T)疗法。但在结直肠癌症(CRC)中,人们发现为了实现免疫治疗效果还存在着缺乏突变衍生新抗原的问题,同时肿瘤的免疫抑制环境也是需要解决的挑战。最近的研究则表明,肿瘤内细菌存在于癌症细胞和肿瘤微环境内的免疫细胞中,有望为癌症免疫疗法提供新表位的替代来源。
肿瘤细胞与细菌(来源:网络)
临床前研究表明,细菌引起的T细胞免疫与癌症细胞的主要组织相容性复合物I类(MHC-I)限制性抗原发生交叉反应,说明菌群特异性T细胞有助于抗肿瘤免疫反应。微生物群引发微生物特异性T细胞反应,而这些反应被认为可以避免自我耐受机制。因此,细菌和宿主共享的同源表位很有可能有助于抗肿瘤免疫的发生。
清除瘤内菌引发抗肿瘤免疫
纳米技术使得在细胞内将小分子输送到肿瘤部位成为可能,而载药纳米颗粒可以特异性地消除细胞内细菌在肿瘤中的定植。因此,北卡莱罗纳大学教堂山分校Leaf Huang(黄力夫)教授等人开发了一种策略,即通过远程装载技术将负载有替硝唑银复合物(LipoAgTNZ)的脂质体递送到细菌感染的小鼠原位CRC肿瘤中。研究显示,通过脂质体递送的针对厌氧细菌的抗生素可从CRC肿瘤中消除细菌,并释放出抗肿瘤CD8 T细胞。基于宿主和定植细菌之间的全基因组比对分析异源和同源表位的实验显示,在致癌核梭杆菌感染模型中,T细胞对核梭杆菌和宿主共享的表位都有反应。因此,通过暴露微生物表位,杀死肿瘤相关细菌可改善癌症治疗结果。相关工作以“Killing tumor-associated bacteria with a liposomal antibiotic generates neoantigens that induce anti-tumor immune responses”为题发表在Nature Biotechnology。

文章要点
越来越多的证据表明,肿瘤微生物群是影响癌症进展的一个因素。在结直肠癌癌症患者中,该研究发现靶向厌氧菌的切除前抗生素施用显著提高了25.5%的无病生存率。因此,针对小鼠研究,作者设计了脂质体包裹的抗生素银硝唑复合物(LipoAgTNZ)。由于越来越多的证据表明,施用广谱抗生素可能会诱导微生物群失调,因此需要一种能有效递送窄谱抗生素对抗缺氧肿瘤区域厌氧细菌的药物递送系统,以减少对肠道共生微生物群的损伤。硝基咪唑是一类抗菌前药片段,在专性厌氧菌中可被铁氧还蛋白氧化还原酶系统还原以发挥活性。硝基的还原活化可形成具有细胞毒性的硝基和其他自由基,导致结构碎片化和对DNA30的细胞毒性。因此,缺氧激活的内在特性使硝基咪唑能够特异性清除缺氧肿瘤中的厌氧菌。硝基咪唑通过环N3供体原子与多种金属离子配位,包括钴(II)、铜(II),锌(II)和银(I)。在这些金属离子中,Ag离子是强效抗菌剂,因此银-替硝唑络合物的形成可以消除原发肿瘤和肝转移中的肿瘤相关细菌,同时也保证了肠道微生物组不会发生失调行为(图1)。
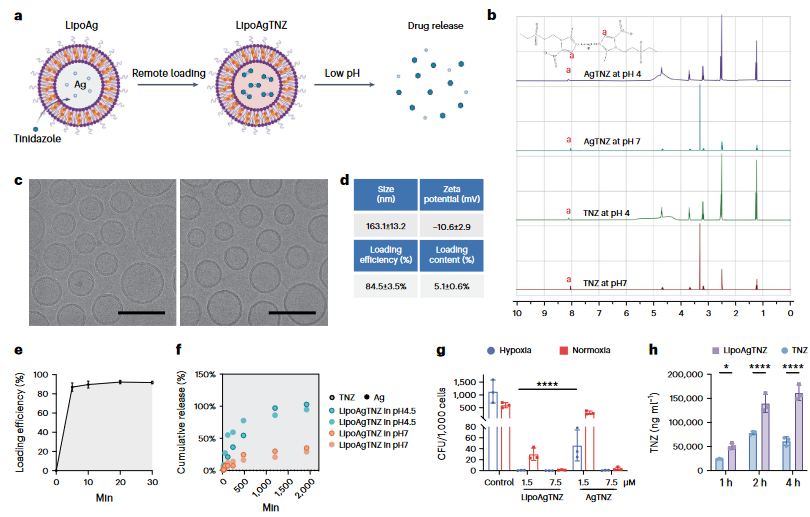
图1 LipoAgTNZ的构建与表征
研究显示,由肿瘤促进细菌(核梭杆菌属)或益生菌(大肠杆菌属)定植的小鼠CRC模型均对LipoAgTNZ治疗有反应,且这两种菌感染的CRC模型的长期存活率超过了70%。对长期存活的小鼠用肿瘤细胞进行皮下再激发后,也没有再检测到肿瘤的生长,表明该治疗可引发免疫记忆反应,也表明通过消除肿瘤相关细菌,免疫抑制微环境已转变为抗肿瘤免疫激活状态。机制分析发现,LipoAgTNZ治疗逆转了转移介质(E-钙粘蛋白、波形蛋白和β-catenin)、Trp53和关键炎症NF-κB通路在具核梭杆菌感染肿瘤中的诱导作用(图2)。与化疗或致癌基因特异性疗法诱导对肿瘤细胞的细胞毒性不同,这种策略针对原发肿瘤和远端转移中的肿瘤相关细菌。而细菌杀伤过程则促进了抗癌反应,恢复了免疫监测,并抑制了原发性肿瘤的生长和转移进展。因此,该研究认为寻找被宿主免疫系统识别的细菌表位是极具意义的。
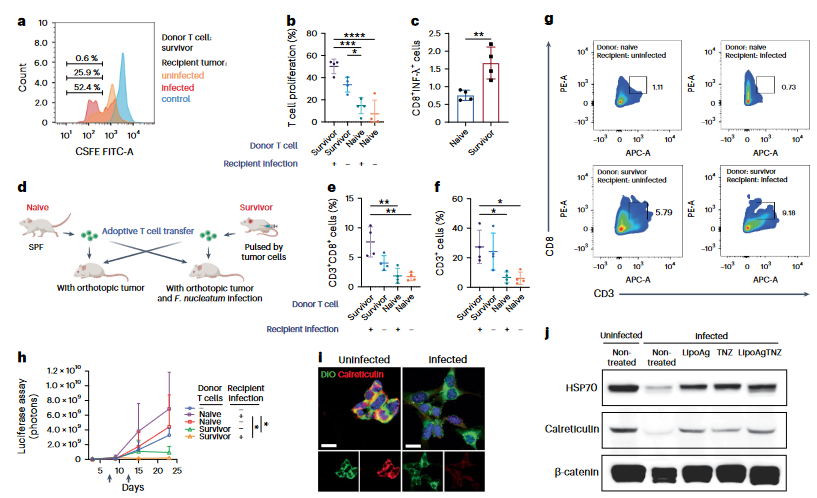
图2 T细胞抑制肿瘤生长
为了探索抗生素治疗后T细胞受体识别的靶点,作者对肿瘤浸润的T细胞进行了四聚体-肽复合物染色。结果显示,在抗生素治疗组中,主要的肿瘤浸润性T细胞特异性是针对细菌-宿主共享表位,这也是诱导针对感染和未感染肿瘤细胞免疫反应的原因。同时,实验数据也表明,在LipoAgTNZ处理后,宿主MHC-I可以呈递细菌表位。与肿瘤相关细菌共享的自身表位的耐受性可能被杀死细胞内细菌诱导的危险信号逆转(图3)。
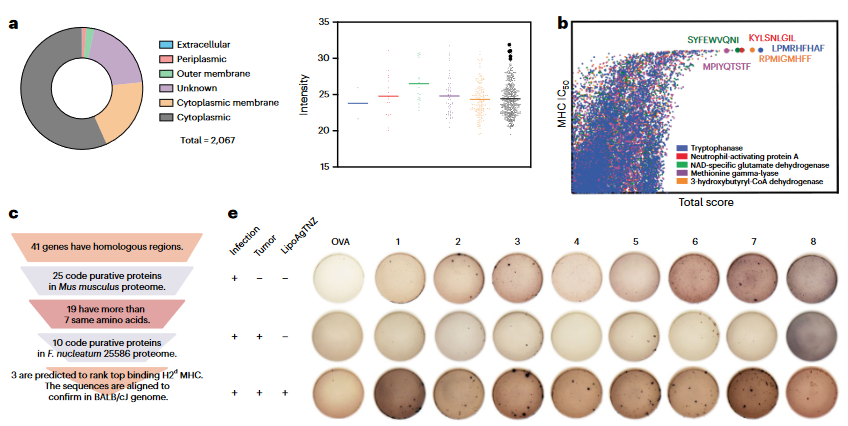
图3 杀伤肿瘤相关细菌可提升对细菌新表位的免疫识别能力
结论与展望
该研究发现,抗生素治疗产生了引发抗肿瘤CD8+T细胞的微生物新抗原。而异源和同源细菌表位均有助于提高免疫原性,启动T细胞识别感染和未感染的肿瘤。上述策略针对肿瘤相关细菌,以引发抗肿瘤免疫,为微生物组-免疫疗法干预铺平道路。
原文链接:
https://www.nature.com/articles/s41587-023-01957-8


