IVD前沿:肿瘤细胞生物标志物检测的研究现状
时间:2023-11-19 19:22:50 热度:37.1℃ 作者:网络
目前早期诊断肿瘤细胞的方法有影像学、组织活检和液体活检。影像学检查微小肿瘤细胞有局限性,组织活检需要采用微创方法从肿瘤组织中提取细胞进行病理检查。相反,液体活检通过检测体液中循环的生物标志物来检测肿瘤,这些生物标志物包括循环肿瘤细胞(CTCs)、蛋白质、囊泡、循环肿瘤DNA (ctDNA)和外泌体。此外,为了对肿瘤细胞进行更灵敏的实时监测,近年来对活细胞内的核酸等分子进行了原位检测和跟踪,比如,microRNAs (miRNAs)和端粒酶。
近日,一组来自中国的研究团队在杂志Microsystems & Nanoengineering上发表了一篇题为“Current research status of tumor cell biomarker detection”的综述文章。文章重点介绍了根据细胞内外不同的肿瘤标志物,利用电化学/荧光传感对其进行检测和分析的最新方法和现状。本文还讨论了不同检测方法在早期肿瘤诊断中的潜在作用以及面临的挑战,并对未来进一步研究提出了重要的关注和见解。

图片来源:Microsystems & Nanoengineering
一 肿瘤细胞标记物的电化学传感
电化学传感器采用酶、抗体、核酸适体等生物分子作为识别元件,电化学电极作为转换元件,生物分子与靶标相互作用所引起的信号变化以电流或电压的形式输出。
01 循环肿瘤细胞
由于外周血中CTC的丰度较低,利用CTC表面过表达的蛋白标记物进行生物富集正受到关注。例如Xu等人开发了一种无标记的电化学免疫传感器,用于检测HepG2肝癌细胞系中表达的上皮细胞黏附分子EpCAM,检测限为2.1x103个细胞/mL(下图a)。
Zhou等人合成了PdRu/Pt结构,用EpCAM抗体修饰的电极特异性捕获CTC。将hemin/G-quadruplex DNAzyme与PdRu/Pt整合作为信号探针识别CTC,形成三明治结构并检测电信号。虽然稳定性较好,但其特异性和敏感性有待提高(下图b)。
Hashkavayi等人开发了一种基于EpCAM适体的电化学传感器,使用金纳米星材料修饰的电极,并通过双信号放大实现了对CTC的高灵敏度检测。该传感器能够在5 ~ 107个细胞/mL范围内对目标癌细胞进行敏感分析,检测限为1个细胞/mL(如下图c)。
Cai等人开发了一种基于抗EpCAM抗体和抗MUC1适配体双重识别的电化学传感器(如下图d)。用BP2000/AuNP复合材料联合EpCAM抗体作为捕获探针,以抗MUC1适体连接的纳米材料作为信号探针。该策略只能检测同时表达EpCAM和MUC1的CTC,检测限低至1 cell/mL。可以检测临床血液样本中的CTC,有望成为肿瘤诊断和转移检测的有前景的平台。
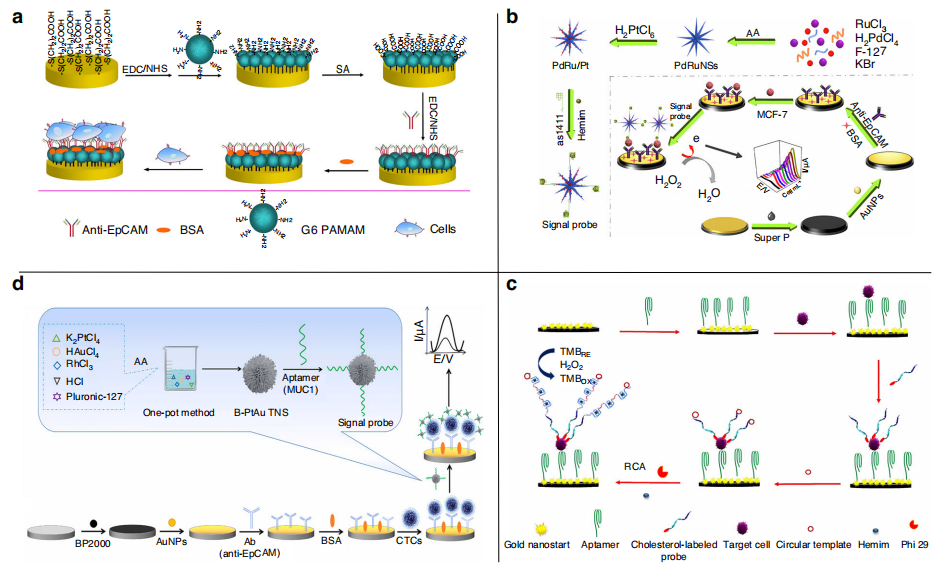
用于检测CTC的电化学传感器。图片来源:Microsystems & Nanoengineering
02 循环肿瘤DNA
DNA Walker具有可编程性和精确碱基配对的优点,广泛应用于生物传感器领域。Li等人设计了一种RCA驱动的DNA Walker,用于ctDNA的超灵敏分析(下图a)。电极由捕获探针和iStep探针组成,可以特异性识别目标DNA,当检测到目标序列时立即触发RCA。该方法在实际样品分析中具有良好的特异性和重复性,检出限为0.29 fM。
Chai等人开发了一种用于ctDNA检测的比率型电化学传感器(下图b)。在原始状态下,电子媒介Fc信号为“开”,MB信号为“关”。识别ctDNA后,DNAzyme链被激活,并启动下一个反应周期,导致两种电化学信号之间的切换,检测限可低至25 aM。
Chen等人构建了基于三维石墨烯/AuPtPd纳米花的CRISPR/ cas9触发的熵驱动链置换反应体系,用于ctDNA的电化学检测(下图c)。基于3D石墨烯/AuPtPd纳米花的高比表面积,结合Cas9/sgRNA的位点特异性切割和ESDR的快速扩增动力学,可用于人血清中ctDNA的多重检测,回收率为91.75% ~ 111.5%。该传感器提供了一种有效检测ctDNA的新方法,在临床和诊断应用中显示出巨大的潜力。
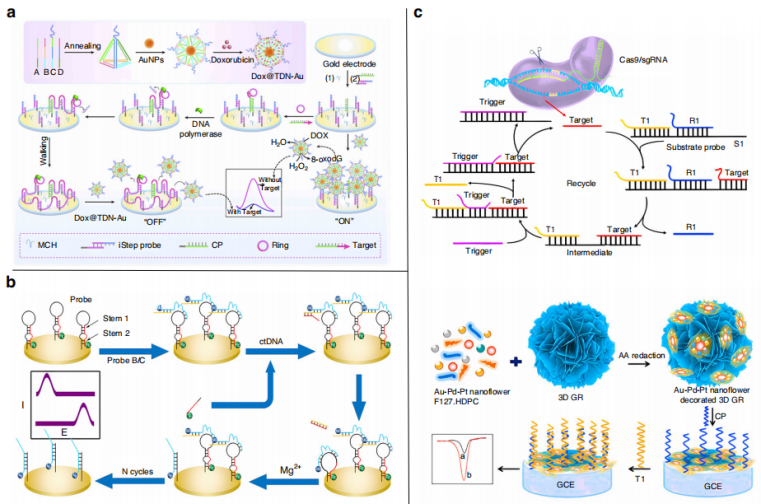
检测ctDNA的电化学传感器。图片来源:Microsystems & Nanoengineering
03 外泌体
在用于外泌体电化学传感的方法中,大多数使用抗CD63抗体或CD63适体作为检测探针。Huang等人报道了一种将hemin/G quadruplex与RCA结合的外泌体无标记检测系统(下图a)。该检测系统选择特定的适体作为检测探针,电极表面修饰的抗CD63作为捕获探针。只有捕获的特异胃癌外泌体才能触发RCA产生多个G quadruplex单元,从而产生电化学信号。该传感器对胃癌外泌体具有很高的选择性和敏感性,检测限为9.54X102 mL−1。
乳腺癌是一种异质性疾病,缺乏特异性肿瘤标志物。为了解决这一问题,An等人同时利用MUC1、HER2、EpCAM、CEA四种蛋白与CD63适体结合,设计了一种三明治结构,可同时电化学分析乳腺癌外泌体表面的四种标记物(下图b)。该传感器在乳腺癌患者血清中检测到外泌体1.0x107个颗粒/μL,相对标准偏差小于6.3%,对乳腺癌的临床诊断具有很大的潜力。
金属有机骨架(MOFs)由于具有高比表面积和持久的传感性能,在传感器设计中得到了广泛的应用。另外,Su等人开发了一种电化学传感器,可与智能手机一起用于外泌体的定量(下图c)。将CD63抗体固定在电极上,将捕获的外泌体与多种生物素化检测抗体结合,与外泌体形成“三明治”复合物。引入的HRP通过链亲和素和生物素与电极表面结合,输出电催化信号。该检测系统可在2 h内检测出5µL血清中CD63阳性外泌体,检出限低至7.23 ng。
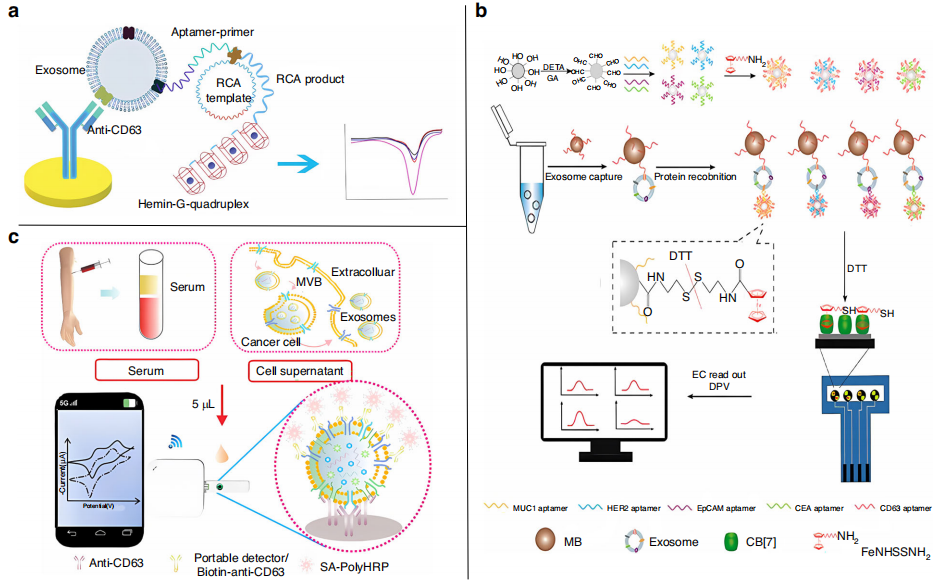
用于外泌体检测的电化学传感器。图片来源:Microsystems & Nanoengineering
二 肿瘤细胞生物标志物的荧光检测
基于荧光的肿瘤细胞生物标记物分析比电化学分析反应更灵敏。除了使用荧光生物传感器检测体液中的细胞外肿瘤标志物外,通过将荧光分析与纳米器件相结合来原位检测活细胞中的细胞内肿瘤生物标志物也受到关注。
01 循环肿瘤细胞
Wu等人创建了一种用于肝细胞癌HCC-CTC检测的双靶向的还原氧化石墨烯膜(rGO)(下图a)。该膜由抗EpCAM抗体修饰的石墨烯膜和Gal-Rh-PAA纳米颗粒组成。在有效捕获HCC-CTC后,被rGO猝灭的荧光得以恢复。该策略可以在1 mL血液样本中检测到5个HCC-CTC。
量子点(Quantum Dots) 由于其宽激发和窄发射的特性,在荧光检测领域得到了广泛的应用。Cui等将ZnS:Mn2+量子点和Fe3O4纳米颗粒包裹在SiO2纳米球中,然后用抗 EpCAM抗体修饰纳米球表面(下图c)。从患者血液中捕获CTCs并进行磁分离后,在荧光显微镜下利用ZnS:Mn2+量子点发出的黄橙色光直接识别CTCs。该策略成功实现了高达90.8%的高捕获效率,并在9例临床乳腺癌患者样本中实现了CTC的特异性荧光标记。
Chen等人使用CTC标记folate受体选择性地结合探针folate--T30(下图b)。与靶标结合后,folate-T30不能被核酸外切酶I识别和切割,并催化延伸反应。CdTe量子点不能识别生成的polyT-CuNPs和Cu2+来产生相应的荧光信号。其荧光信号检测限低至0.25 cells/mL, 1 cell/mL时肉眼就能分辨出信号,为目前CTC POCT存在的问题提供了一种潜在的解决方案。
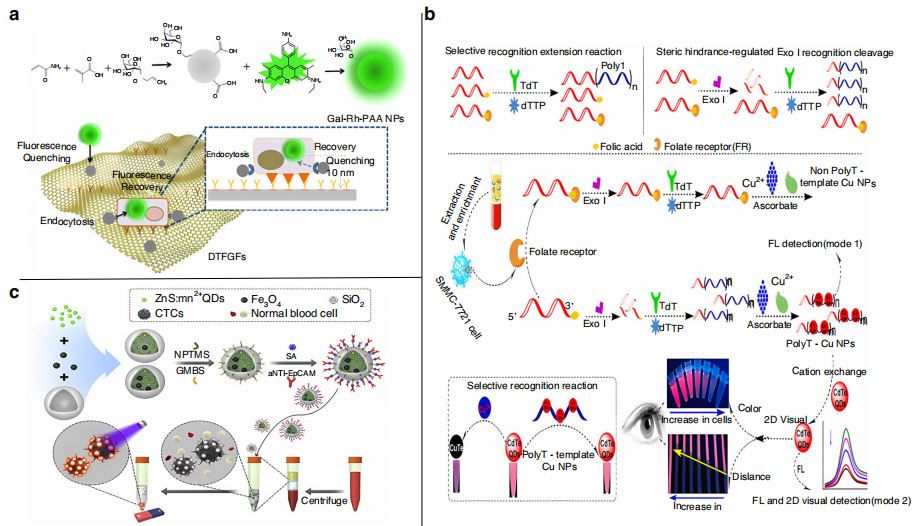
用于CTC检测的荧光生物传感器。图片来源:Microsystems & Nanoengineering
02 循环肿瘤DNA
Tadimety等将肽核酸探针偶联到金纳米棒上,对溶液中的ctDNA进行序列特异性捕获,捕获ctDNA导致纳米棒吸收峰波长发生变化(下图a)。该传感器为患者血清中ctDNA的无扩增荧光检测提供了一种新的方法,有效检测限为2 ng/mL。
近年来,纳米材料因其优异的光学和电催化性能被广泛应用于新型生物传感平台的构建。Wang等人构建了一个基于FRET的ctDNA敏感检测系统,该系统利用了上转换纳米颗粒(UCNPs)(下图b),当UCNPs上单链DNA的foothold区捕获样品中游离的ctDNA时,ctDNA触发foothold介导的链置换反应,UCNPs的荧光被恢复。利用该传感器对人血清样品中的ctDNA进行空白加标回收率实验,回收率在93.14% ~ 98.51%之间。
AgInS2量子点不仅具有优良的量子点性能,而且具有低毒性和环境友好的优点。Yang等人设计了一种传感器(下图c),目标DNA触发HCR反应,导致附着在发夹探针B和C上的量子点积累。可以通过检测磁分离后上清中量子点产生的荧光信号强度来定量ctDNA。HCR过程放大了检测信号,提高了检测灵敏度,检测限低至53 aM,本研究为ctDNA检测提供了一种快速、方便、灵敏的方法。
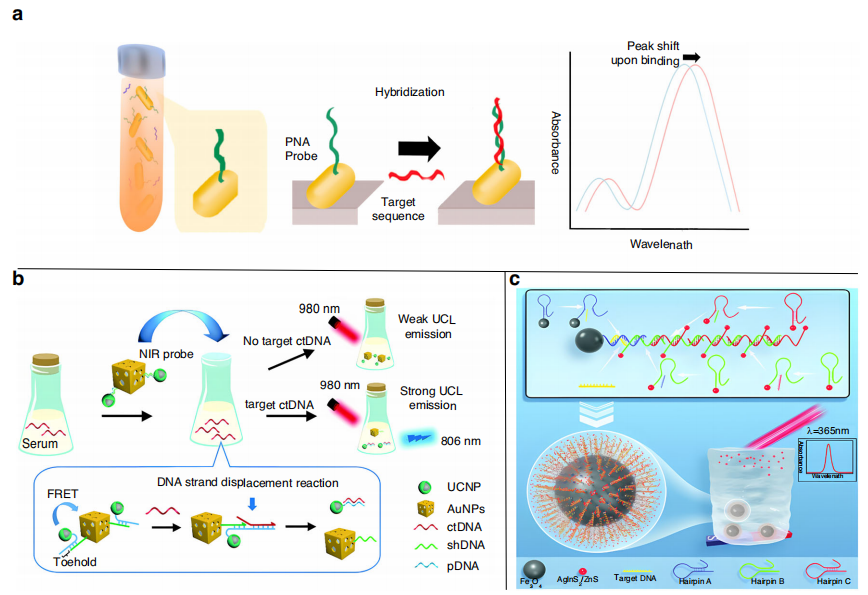
检测ctDNA的荧光生物传感器。图片来源:Microsystems & Nanoengineering
03 外泌体
磁性纳米材料被广泛应用于外泌体的检测。Wang等人使用抗CD63抗体磁珠从复杂样品中捕获并富集外泌体(下图a),在发夹探针的作用下触发无酶DNA信号扩增的环扩增,过程中引入含有荧光团的探针来检测和分析外泌体。外泌体的检出范围为5.5x103 ~ 1.1x107颗粒/mL,检出限为1.29x103颗粒/mL。
基于FRET的荧光分析系统也为多种生物分子的定量分析提供了新的平台。Zhu等人将核酸适体、量子点与FRET效应相结合(下图b),当适体与互补DNA配对时,由于FRET OFF,形成的QDs-APT/DNA- AU复合物荧光信号微弱。当相应的外泌体与适体结合并解离Au-DNA时,荧光信号通过FRET ON机制增强。所构建的FRET磁性适体传感器能够快速有效地将7份肺癌样本和5份其他癌症样本与健康对照样本区分开来,准确率为100%。
分子印迹聚合物(MIPs)是一种以靶分子为模板的合成受体,已被广泛用作生物传感分析中抗体的替代品。Feng等人构建了一种基于FRET的双选择性MIPs外泌体荧光传感器(下图c)。该传感器利用磁性MIPs选择性捕获外泌体,并与适体/氧化石墨烯形成三明治结构,导致FRET选择性开启,对血清中的外泌体的检测限为2.43X106颗粒/mL。
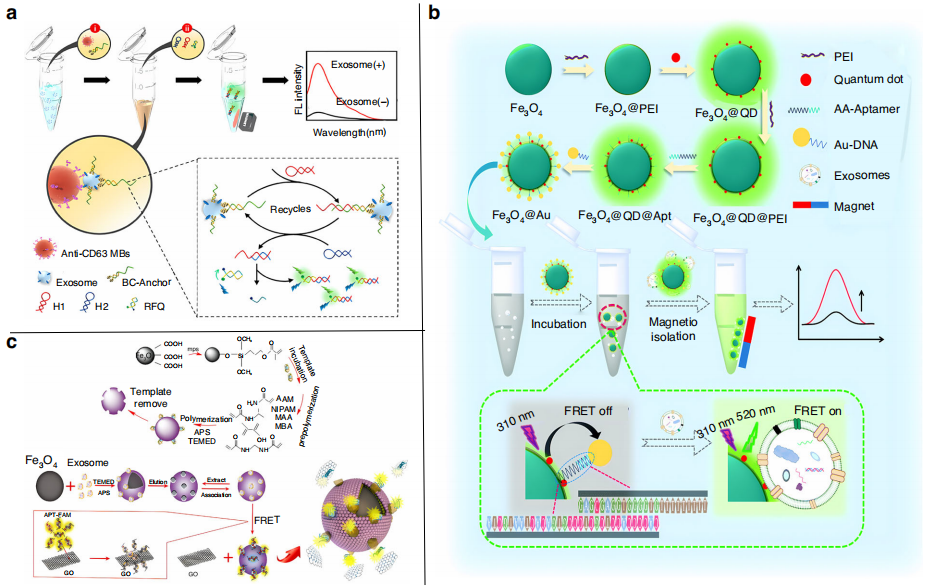
检测外泌体的荧光生物传感器。图片来源:Microsystems & Nanoengineering
04 端粒酶
开发用于荧光成像和检测活细胞中低丰度端粒酶活性的灵敏探针需要将探针送入细胞并在保持细胞活性的同时完成检测。Ye等人设计了一种结合荧光和表面增强拉曼散射(SERS)技术的跷跷板比率(SR)探针(下图a)。SR探针是由两个发夹DNA杂交合成的,H1用纳米金和Cy3染料修饰,H2用Rox染料修饰并含有端粒酶引物。在端粒酶缺失的情况下,Rox呈现荧光off/Raman on表型,Cy3呈现荧光on/Raman off表型。端粒酶的存在时会导致Rox和Cy3的荧光及Raman表型发生改变。该策略检测到活乳腺癌细胞中8.604x10−12 IU的端粒酶活性。
Yue等人设计了具有FRET功能的四面体DNA纳米探针(下图b)。探针由端粒酶引物和标记有荧光团Cy3和Cy5的分子信标组成,其中端粒酶引物在端粒酶存在下被延长,并且替换基于FRET的分子信标以刺激FRET反应。这种策略允许四面体DNA纳米探针通过内吞作用将核酸输送到细胞质中进行检测,而无需使用转染试剂。
Zhang等人设计了一种DNA四面体探针(下图c)。DNA四面体探针可以装载端粒酶引物以及用三种不同荧光团标记的分子信标。在端粒酶存在的情况下,装载在该探针上的分子信标被连续打开,依次产生不同发射波长的多色荧光信号。该DNA四面体探针具有良好的生物相容性,为实时监测肿瘤细胞端粒酶活性提供了新的思路。
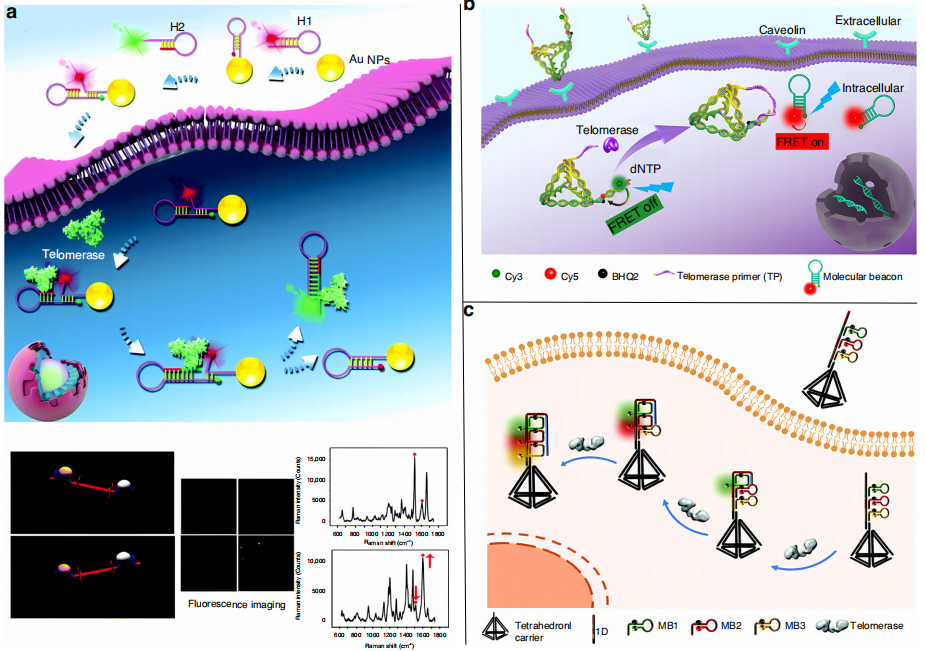
活细胞端粒酶的荧光分析。图片来源:Microsystems & Nanoengineering
05 miRNA
Zada等人率先利用二维Mo2B纳米片作为载体,利用其猝灭荧光染料的能力与HCR结合,成功监测了癌细胞中miRNA表达的变化(下图a)。Mo2B纳米片表面装载了发夹探针,可识别特异性靶miRNA并触发HCR反应,产生了DNA-miRNA双螺旋结构并产生强荧光。该方法能够对多个miRNA进行成像,为分析活细胞中miRNA的表达模式提供了一种新的方法。
硅量子点(Si QDs)具有低毒性和优异的生物相容性,是具有代表性的无机纳米材料。此外,Li等提出了结合分子信标纳米探针的DNA四面体框架来特异性识别miR-214(下图b)。没有miR-214时,纳米探针由于FRET效应处于“关闭”状态。当分子信标识别miR-214,探针结构发生变化,导致荧光信号恢复。该方法可实现活细胞中肿瘤相关miRNA的实时荧光成像。
Pop等人设计了另一种基于纳米吸管的电穿孔传递平台的miRNA检测方法(下图c)。该平台通过低压电穿孔和电泳相结合的方式将miRNA直接送入活细胞。电场关闭后,细胞膜可在10分钟内迅速愈合。该策略有望在对细胞干扰最小的情况下,能够探测miRNA浓度变化导致的疾病状态信号变化。
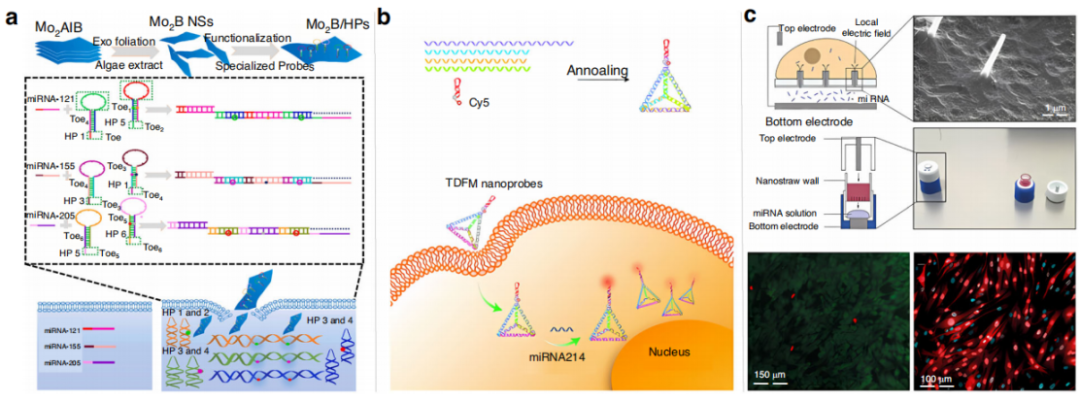
活细胞中miRNA的荧光分析。图片来源:Microsystems & Nanoengineering
三 液体活检的商业化技术
Biocept是一家专门从事癌症检测技术的生物技术公司。该测试在多个临床试验中显示出很高的准确性和敏感性。此外,Guardant Health开发的Guardant360血液检测技术可以识别肿瘤的特定变体,并帮助医生为患者选择最合适的治疗方案。另一种可用于ctDNA分析的商业选择是Thrive Earlier Detection开发的CancerSEEK血液检测技术,其检测特异性高达99%,有望发展成为多分析物检测的无创血液检测技术。Illumina的TruSight Oncology 500血液检测主要基于下一代基因测序技术,已在多个患者中鉴定出PIK3CA和TP53功能丧失等突变。Freenome医疗技术公司通过人工智能分析人类血液样本中的DNA片段,致力于在早期发现癌症。未来,这些技术有望成为无创癌症筛查的重要方法,通过更准确的肿瘤检测和诊断,使更多的患者尽早得到治疗。
四 总结与展望
本文综述了基于电化学和荧光两种主要原理的细胞外和细胞内肿瘤生物标志物的检测方法。在细胞外肿瘤标志物的检测方法中,电化学传感具有较高的灵敏度和选择性(下表1),但其稳定性和重复性仍需进一步研究。荧光传感也具有良好的灵敏度和低背景信号检测能力,在POCT中有很好的应用前景,但其检测速度和效率仍不尽人意。细胞内标记物的荧光检测仍然面临着巨大的挑战,因为需要平衡细胞活性、高精度和灵敏度; 例如,在利用内吞作用递送纳米探针进行检测时,纳米材料的毒性是不可忽视的。了解纳米材料的毒性将有助于设计出副作用更小的纳米材料,而开发体内和体外纳米材料毒性评估机制是实现肿瘤细胞原位监测的重要组成部分。此外,将各种安全的纳米探针集成到可穿戴的超灵敏生物传感器中,以及将现有技术从实验室转化为临床实践,仍然是实现肿瘤标志物早期监测的主要挑战。随着电穿孔等物理递送方法的出现和不断完善,未来的研究重点应放在构建标准化的纳米器件上,以提高临床早期、精确检测肿瘤细胞和靶向治疗的效率,从而满足大规模商业应用的需要。
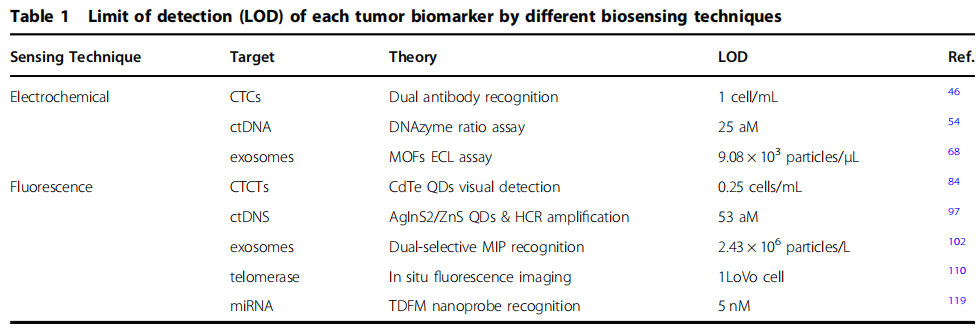
不同生物传感技术对每种肿瘤生物标志物的检测限(LOD)。图片来源:Microsystems & Nanoengineering


