汕头大学医学院姜红岩/凌凯团队《ACS Nano》:多学科交叉助力乳腺癌免疫治疗
时间:2024-01-26 19:14:13 热度:37.1℃ 作者:网络
肿瘤免疫疗法旨在激发人体自身免疫系统针对癌细胞的攻击并产生长效记忆,以减少肿瘤转移和复发,实现治愈。但是实体肿瘤由于存在免疫抑制的肿瘤微环境,现有的PD-1免疫检查点抑制剂和CAR-T细胞疗法等先进免疫治疗手段难以取得理想的治疗效果。这已成为当前肿瘤治疗领域研究的热点与挑战。
最近,汕头大学医学院姜红岩/凌凯团队在ACS NANO发表题为“Mn2+/CpG Oligodeoxynucleotides Codecorated Black Phosphorus Nanosheet Platform for Enhanced Antitumor Potency in Multimodal Therapy” 的研究论文。该研究利用黑磷纳米片(BPNS)与锰离子(Mn²⁺)和CpG寡核苷酸进行复合,制备出“BPNS@Mn²⁺/CpG”纳米药物。在细胞及动物模型实验中,该药物表现出良好的稳定性,减少了非靶向的毒副作用。在实体肿瘤(乳腺癌)的微酸性肿瘤环境中,该药物能够迅速分解并释放锰离子和CpG核酸药物,有效激活了肿瘤内的抗原递呈细胞,逆转了肿瘤微环境的免疫抑制状态。

【文章要点】
本研究利用黑磷纳米片(BPNS)制备出Mn²⁺和CpG ODNs共载的黑磷纳米药物(BPNS@Mn2+/CpG),用于有效共同传递免疫治疗的CpG ODNs和Mn2+到肿瘤中。因此基于此纳米药物,建立了一种高效的抗肿瘤疗法,在808nm激光辐照下产生了光热、光动力、化学动力等多模式协同治疗效果获得了强效抗肿瘤疗效。并且,CpG ODNs和Mn2+的共同传递通过同时激活肿瘤微环境中TLR9和STING通路中,激活了肿瘤微环境中的抗原递呈细胞,有效地逆转了肿瘤微环境中的免疫抑制,使肿瘤相关巨噬细胞从促肿瘤的M2表型极化为具有抗肿瘤作用的M1表型,促进了树突状细胞的成熟,并增加了CD4+和CD8+ T淋巴细胞对肿瘤的浸润,从而激发出强烈的抗肿瘤免疫应答,阻止了肿瘤(乳腺癌)的转移。
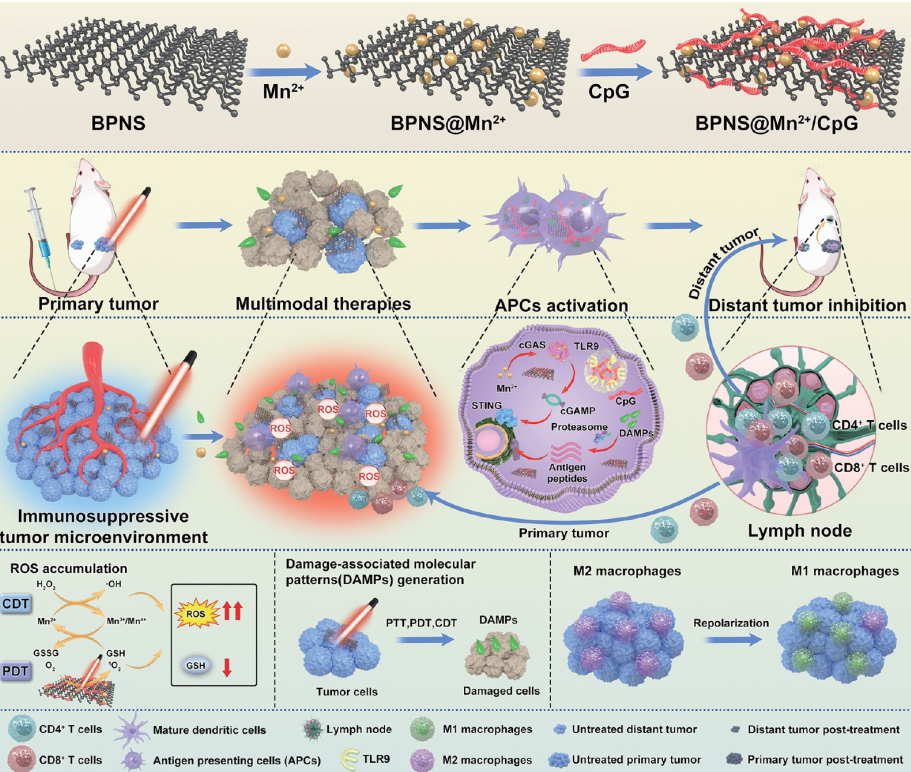
图1. BPNS@Mn2+/CpG纳米药物制备步骤与治疗机理
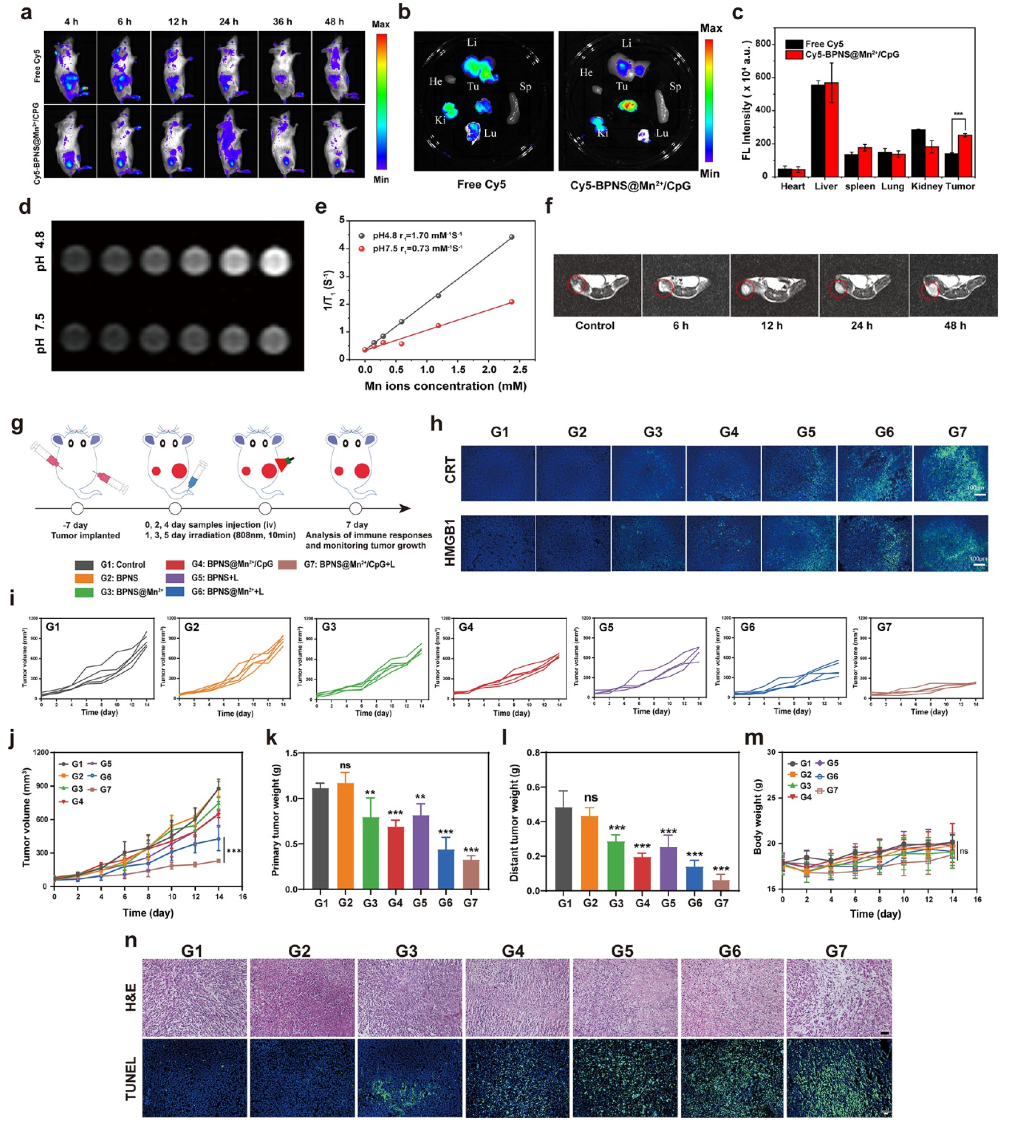
图2. BPNS@Mn2+/CpG纳米药物体内靶向性及治疗效果
通过动物表明,BPNS@Mn2+/CpG纳米药物对于肿瘤具有较高的靶向性,在尾静脉注射后将逐渐聚集到肿瘤部位,抑制了肿瘤的生长与转移。由于该纳米药物结合了大量的锰离子,因此还可以用于体内肿瘤的实时磁共振成像(NMR)。这一多模态治疗策略不仅改善了肿瘤微环境,还展现了在DNA/药物输送和肿瘤免疫治疗领域巨大的应用潜力。
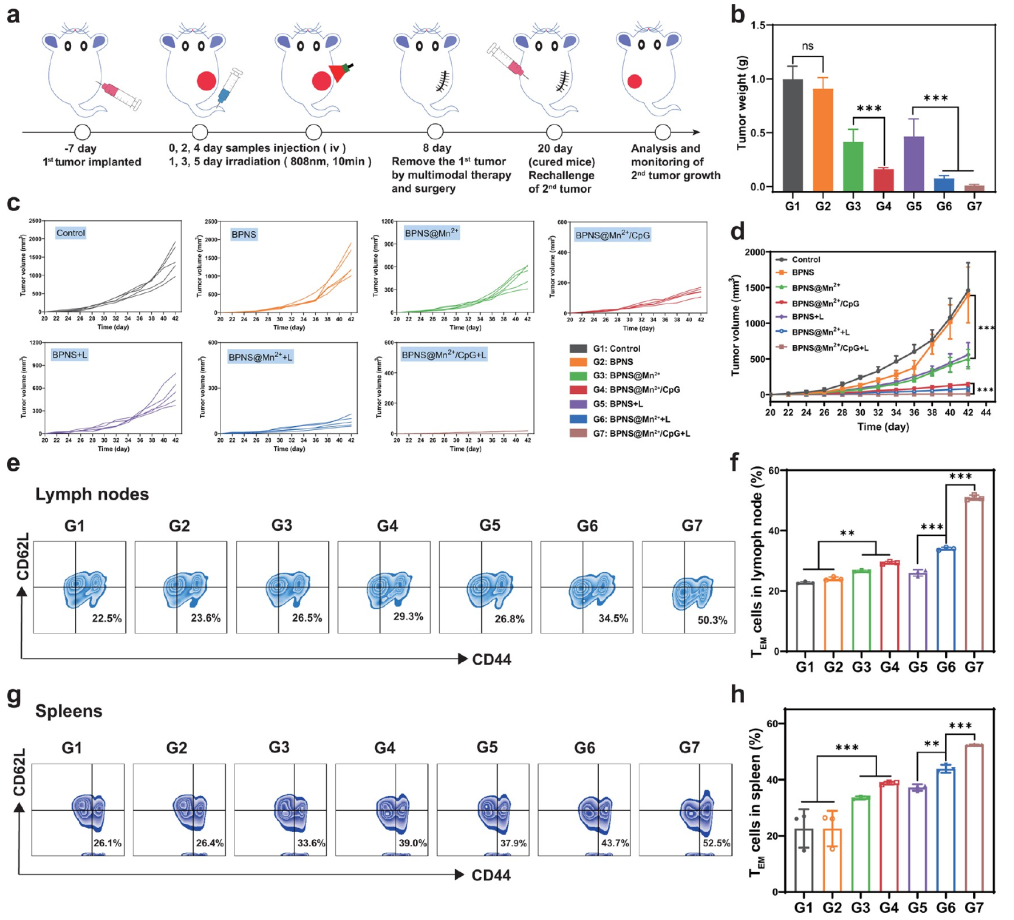
图3. BPNS@Mn2+/CpG纳米药物抑制肿瘤复发效果
由于BPNS@Mn2+/CpG纳米药物逆转了免疫抑制的肿瘤微环境,并扩充了淋巴中的记忆T细胞。因此基于此纳米药物治疗后的小鼠将具有抗肿瘤复发的能力。
【结论与展望】
在本研究中,该团队成功开发了一种金属离子修饰的黑磷纳米片(BPNS@Mn2+/CpG)药物,用于有效共同传递免疫治疗的CpG ODNs和Mn2+到肿瘤中,建立了一种转化的抗肿瘤策略,实现了多模式治疗的期望协同效应和强效抗肿瘤疗效。CpG ODNs和Mn2+的共同传递通过在抗原呈递细胞中同时激活TLR9和STING途径,有效地逆转了肿瘤微环境中的免疫抑制,使肿瘤相关巨噬细胞从促肿瘤的M2表型极化为具有抗肿瘤作用的M1表型,促进了树突状细胞的成熟,并增加了CD4+和CD8+ T淋巴细胞对肿瘤的浸润。这些结果表明了该研究在多模式治疗和免疫治疗方面的潜在应用和重要意义。该研究为进一步开发基于金属离子修饰的纳米药物及其治疗策略提供了新的思路,在肿瘤治疗和免疫治疗中具有潜在的应用前景。此外,该研究也为多模式治疗策略的发展提供了有益的启示,有望为未来的肿瘤治疗研究和临床应用提供新的方向和可能性。
汕头大学医学院凌凯副研究员、硕士生郑金涛、江晓红为论文的共同第一作者,汕头大学医学院姜红岩副教授为论文的通讯作者。本研究受国家自然科学基金、广东省自然科学基金、和汕头大学广东省分子生物医学国际合作中心的资助与支持。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.3c07123


