浙江大学王杭祥团队《ACS Nano》:肿瘤切除术后可原位注射凝胶用于抗肿瘤免疫治疗
时间:2024-06-02 18:00:39 热度:37.1℃ 作者:网络
2024年5月29日,浙江大学医学院附属第一医院王杭祥研究员团队在《ACS Nano》在线发表了题为“Syringeable Near-Infrared Light-Activated In Situ Immunogenic Hydrogel Boosts the Cancer-Immunity Cycle to Enhance Anticancer Immunity”的研究论文。该研究设计了用于肿瘤切除术后可原位注射的、具有近红外激光响应并负载多种纳米治疗药物的免疫激活水凝胶(iGEL)。通过光动力治疗、化疗及免疫激动剂的协同治疗,增强肿瘤-免疫循环(cancer-immunity cycle)。溶液通过注射器混合并注射,可实现在瘤旁或原位肿瘤切除术后的不规则空腔内定植,通过局部给药的方式达到原发性肿瘤的抑制和远端效应(图1)。
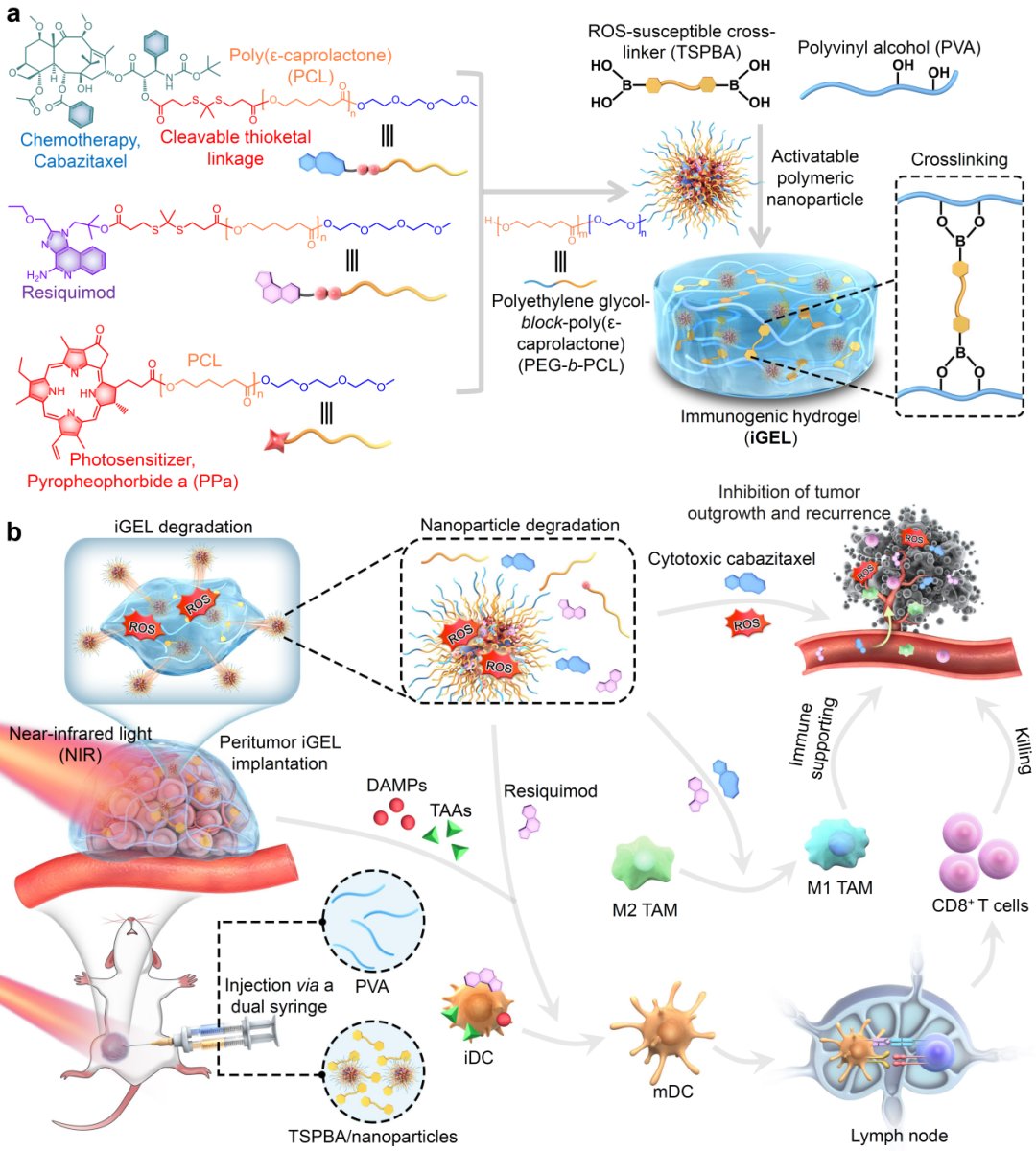
图1、原位形成的近红外响应性水凝胶(iGEL)及其抗肿瘤治疗。
研究表明,水凝胶药物递送系统实现了负载药物的持续释放,然而水凝胶缓慢的释放动力学削弱了其疗效、增加了系统毒性。为了解决这一问题,研究人员设想通过光动力疗法(Photodynamic therapy,PDT)产生的活性氧(ROS)作为水凝胶降解的“开关”,实现负载药物的受控释放和特异性抗肿瘤免疫的激活。研究人员采用ROS敏感的缩硫酮键将聚己内酯与化疗药卡巴他赛(cabazitaxel)、TLR7/8激动剂resiquimod共价偶联,得到前药偶联物。将前药偶联物与聚己内酯偶联的光敏剂焦脱镁叶绿酸-a(PPa)共组装,生成光可激活的纳米制剂。该纳米制剂可通过ROS敏感的水凝胶骨架,进一步制备成可注射的、近红外光响应的免疫激活型水凝胶(iGEL)。
在近红外光照射下产生的ROS具有双重作用:1)诱导iGEL降解和活性药物的释放,通过杀伤肿瘤细胞、诱导树突状细胞的成熟、诱导肿瘤相关巨噬细胞向M1方向极化,激活抗肿瘤免疫;2)诱导肿瘤细胞的免疫原性细胞死亡(immunogenic cell death,ICD),释放损伤相关分子模式,刺激树突状细胞成熟并活化T淋巴细胞杀伤肿瘤细胞,进一步促进肿瘤免疫循环。体外实验证实了iGEL能诱导肿瘤细胞杀伤、肿瘤相关巨噬细胞向M1方向极化、ICD、树突状细胞成熟及抗原呈递能力增强(图2)。
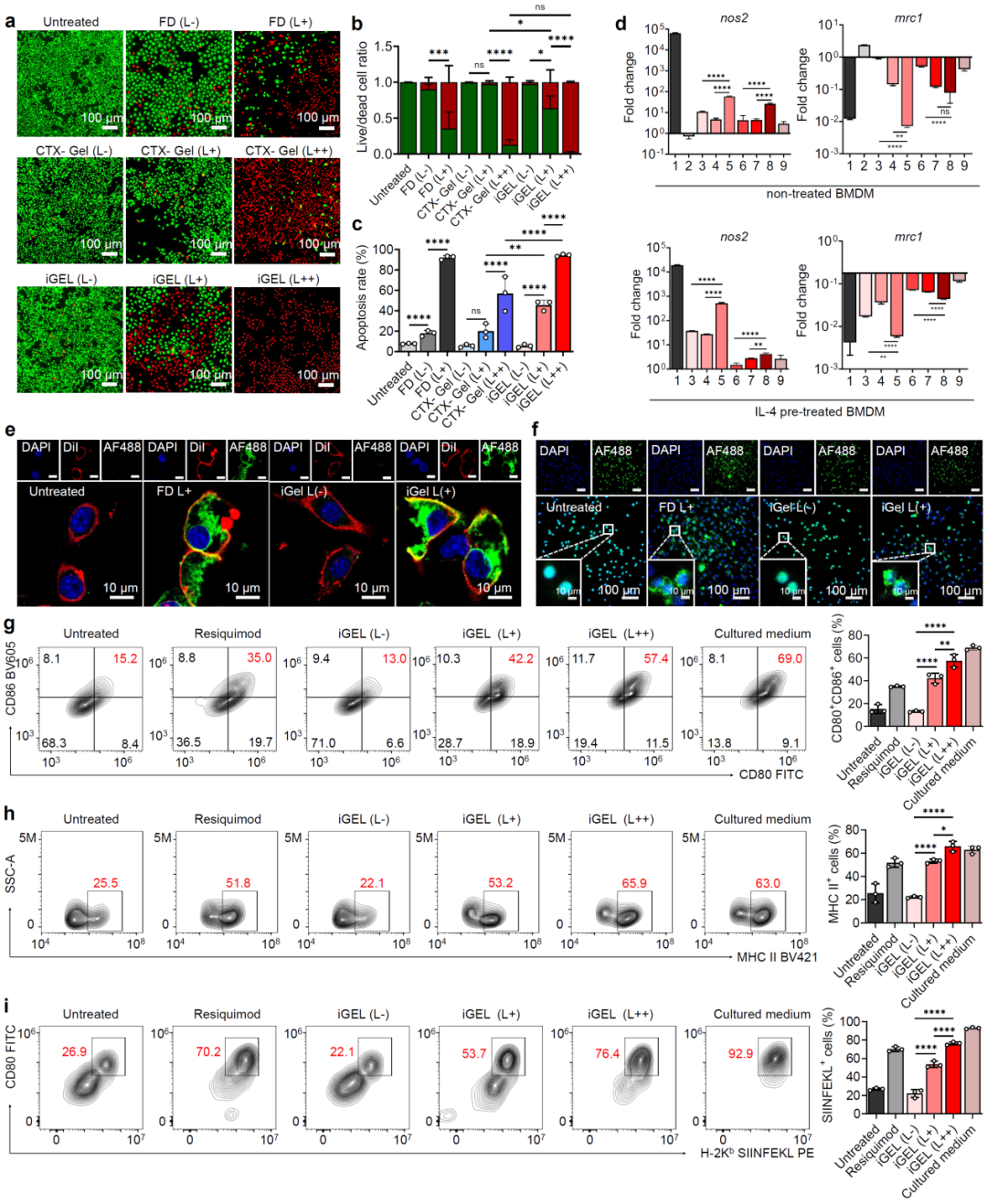
图2、近红外光照射下,iGEL有效杀伤肿瘤细胞并激活抗肿瘤免疫。
iGEL在B16F10黑色素瘤模型上呈现出优异的抗肿瘤疗效。瘤旁注射的iGEL在近红外光照射后诱导肿瘤体积缩小,且实现了部分小鼠的治愈,显著延长了小鼠的中位生存时间。进一步研究发现,iGEL改善了肿瘤免疫微环境,并激活了显著的全身性抗肿瘤免疫。iGEL增强了树突状细胞成熟并促进细胞毒性T淋巴细胞的瘤内浸润,并促进了外周血中抗肿瘤免疫相关的细胞因子浓度升高。在B16F10-OVA黑色素瘤模型中,iGEL也表现出优异的抗肿瘤疗效。值得注意的是,流式细胞术、ELISpot分析揭示了OVA特异性的细胞毒性T淋巴细胞显著活化,证实了iGEL诱导的免疫激活为特异性抗肿瘤免疫(图3)。
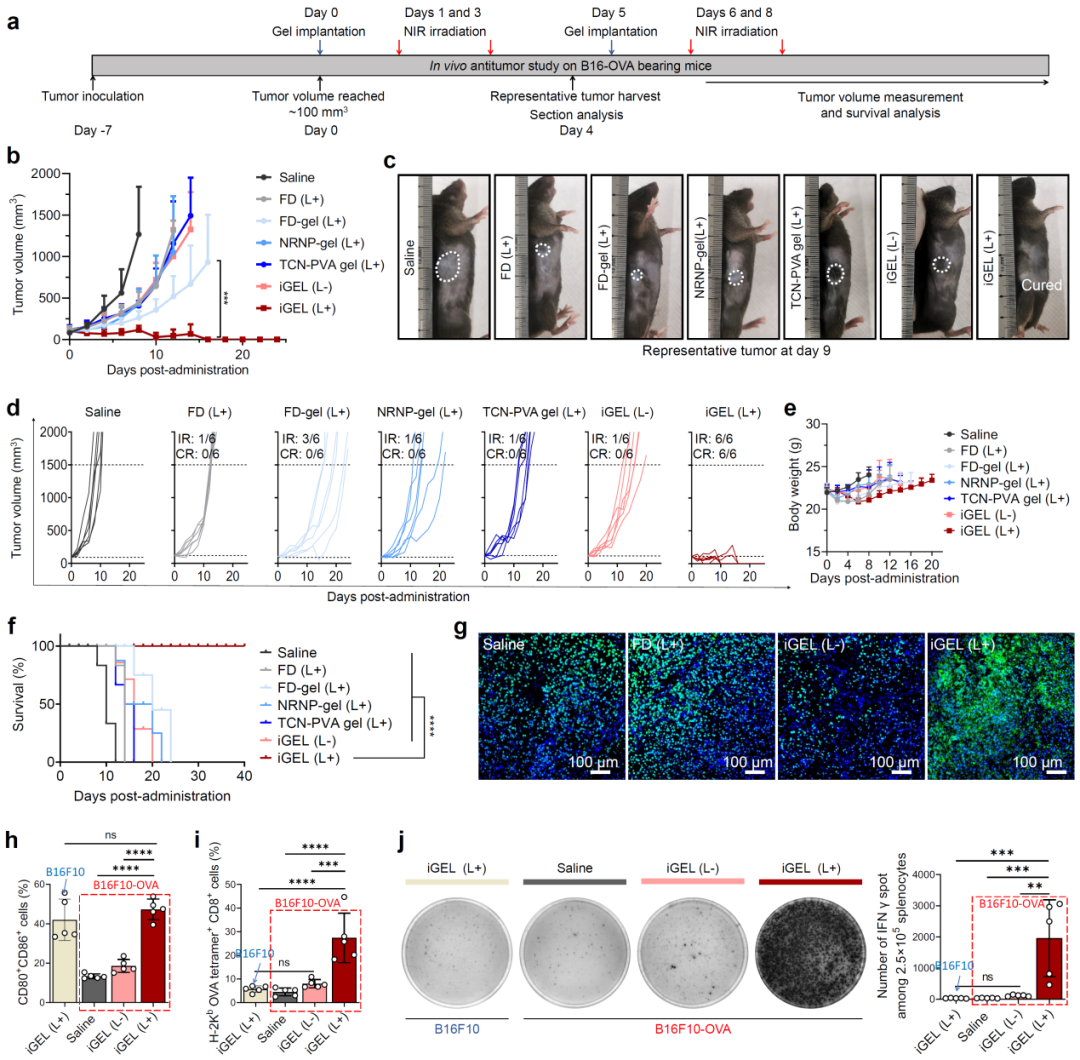
图3、近红外光照射下,iGEL有效杀伤B16F10-OVA黑色素瘤并激活特异性抗肿瘤免疫。
原位肿瘤切除术后的复发和转移是导致患者死亡的主要原因。因此,研究人员在4T1原位乳腺癌切除术后在手术空腔内植入iGEL以探究其抑制复发转移的能力。在近红外光照射下,iGEL显著抑制了乳腺癌的复发及远侧转移,在超过半数的小鼠上实现了长期无瘤生存(>120天)(图4)。
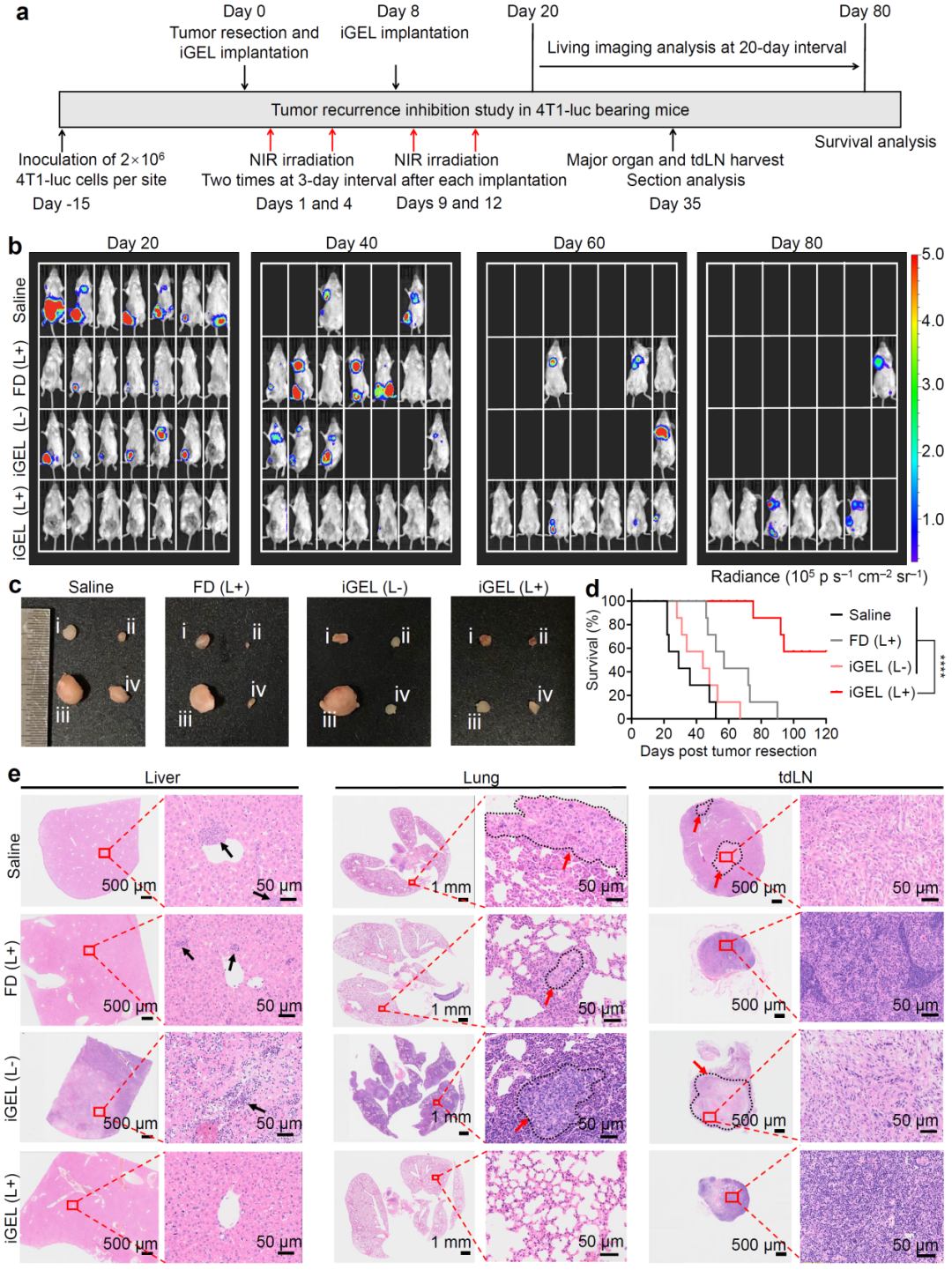
图4、近红外光照射下,iGEL抑制4T1乳腺癌术后肿瘤复发及转移。
本研究表明,可原位注射的、具有近红外激光响应并负载多种纳米治疗药物的免疫激活水凝胶有效促进癌症免疫循环,实现了优异的抗肿瘤效应。该凝胶递送系统具有多种优势,包括多样的纳米颗粒负载能力、时空控制的药物激活以及更低的全身毒性,可应用于肿瘤切除术后残余肿瘤细胞清除等场景,具有临床应用前景。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.3c08425


