【协和医学杂志】术后返回ICU患者亚急性和慢性疼痛发生率及影响因素分析
时间:2024-07-08 15:02:08 热度:37.1℃ 作者:网络
术后持续性疼痛包括术后持续或反复发作3个月以上的慢性疼痛及持续1个月以上的亚急性疼痛[1]。约10%的患者在接受不同手术后出现中重度持续性疼痛[2]。术后亚急性和慢性疼痛可能导致患者不适、抑郁、失能,且与阿片类药物危机相关,逐渐受到临床关注[3-5]。
研究表明,30%的术后返回ICU患者存在6个月以上持续性疼痛,14%~77%存在1年以上持续性疼痛[6]。ICU常采用的监护或治疗措施包括可能导致疼痛或不适的有创操作、多种控制疼痛及辅助维持血流动力学稳定的阿片类药物、参与炎性反应的免疫调节药物等[7],这些因素可能与ICU患者康复后持续性疼痛发生率高于普通人群相关[6,8-9]。
在一项需要重症监护疾病的多中心前瞻性研究中发现,274例术后返回ICU的患者中119例患者出现术后持续性疼痛[10]。虽然既往研究分别探讨了术后或术后返回ICU患者的亚急性及慢性疼痛情况,但对于术后返回ICU患者的亚急性及慢性疼痛情况鲜有报道。因此,本研究分析术后返回ICU患者的亚急性及慢性疼痛发生情况及影响因素,以期为此类患者的临床诊疗及预后改善提供借鉴。
1 资料与方法
1.1 研究对象
本研究为单中心观察性研究,根据纳入标准选择2021年11月29日~2021年12月31日在北京协和医院接受手术治疗并于术后返回ICU的患者进行电话问卷调查。
纳入标准:
1
年龄≥18岁;
2
术后返回ICU;
3
临床资料完全。
排除标准:
1
存在认知、交流障碍;
2
不能理解数字评价量表(NRS);
1
失访;
2
不愿意参与本研究的患者。
本研究已通过北京协和医院伦理审查委员会审批(审批号:S-K1959),并获得患者及其家属口头知情同意。
1.2 研究方法
1.2.1 数据收集
查阅电子病历系统、麻醉记录单和重症监护管理数据库。采集围术期病史资料,包括性别、年龄、身高、体质量、吸烟史、饮酒史、基础合并症(高血压、冠心病);收集ASA分级,手术类型(神经外科、骨科、胸外科、心脏外科,妇科,肝脏外科,产科,耳鼻喉科,血管科,泌尿外科,基本外科),手术时长,ICU住院时长等资料。
1.2.2 随访
根据患者住院病历上的电话号码,于术后1个月和3个月对每例患者进行电话随访问卷调查。随访内容包括:
1
疼痛发生情况:有无手术部位和/或其他部位的疼痛(NRS评分>0)。
2
疼痛强度:采用NRS进行评价,范围为0~10分,其中0分代表无痛,10分代表无法忍受的疼痛。疼痛强度按NRS评分分为轻度、中度、重度3级:1~3分为轻度疼痛,4~6分为中度疼痛,7~10分为重度疼痛。
3
疼痛部位(上肢,下肢,腹部,胸部,背部、腰骶部,臀及会阴区,头面颈部)、手术和非手术部位。
4
疼痛性质(包括钝痛、锐痛、虫噬样痛和其他等)。
1.2.3 结局指标
主要结局指标为术后返回ICU患者慢性疼痛发生率,慢性术后疼痛被定义为术后出现的慢性疼痛且持续时间≥3个月(NRS评分>0)。
次要结局指标包括:术后返回ICU患者亚急性疼痛发生率,亚急性及慢性疼痛的人群特征、强度、部位、性质及影响因素。
1.3 样本量估算
根据Kendall 样本量粗略估计方法,样本量至少为自变量的5~10倍。本研究预调查11个与术后返回ICU患者慢性疼痛相关的自变量,假设样本量为自变量的5倍,术后返回ICU患者慢性疼痛发生率约为40%,经估算所需样本量约为137例。
1.4 统计学处理
采用SPSS 25.0进行统计学分析。符合正态分布的计量资料以均数±标准差表示,不符合正态分布的计量资料以中位数(四分位数)表示,计数资料以频数(百分数)表示。计量资料正态性和方差齐性分别采用Shapiro-Wilk和Levene's检验进行评估,组间比较采用t检验或秩和检验;计数资料组间比较采用χ2检验或Fisher精确检验。将组间比较时P<0.15的因素进行多重共线性检验去除共线性变量后纳入多因素Logistic回归分析,以确定慢性术后疼痛的影响因素,结果以OR值及95%置信区间描述。检验水准α=0.05,采用双侧检验。
2 结果
2.1 患者临床资料
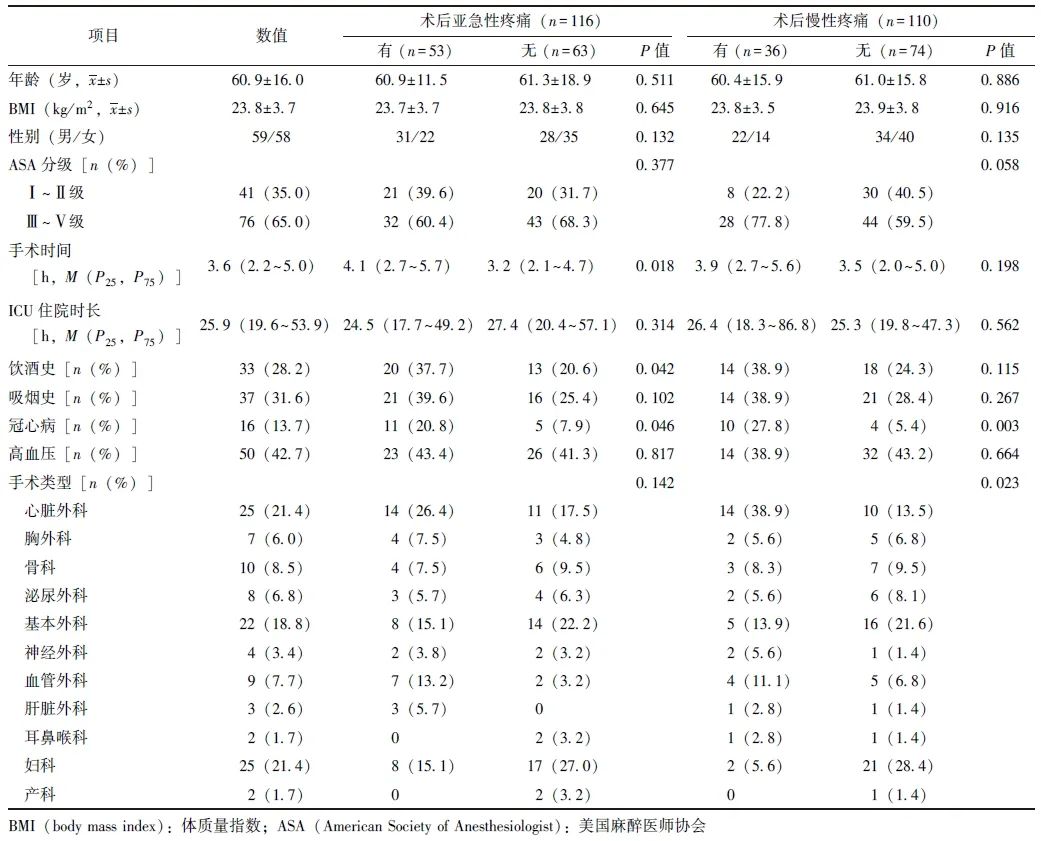
根据纳入标准,共129例患者被纳入研究。术后1个月和3个月电话随访问卷应答率分别为89.9%(n=116)和85.3%(n=110),最终有117例(90.7%)在一次或多次电话随访时提供了完整的结局数据,并被纳入完整的病例分析,其中男性59例、女性58例,平均年龄(60.9±16.0)岁。平均体质量指数(BMI)为(23.8±3.7)kg/m2。高血压是最常见的合并症(42.7%)。31.6%的患者吸烟,28.2%的患者饮酒。涉及的手术类型详见表1。
表1术后返回ICU患者一般资料、亚急性及慢性疼痛影响因素的单因素分析
2.2 术后亚急性和慢性疼痛的强度、部位和性质
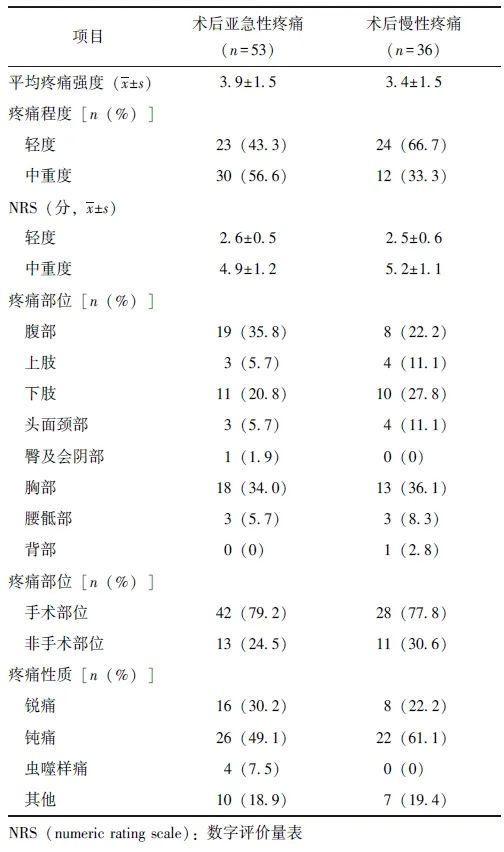
术后返回ICU的患者中有53例(45.7%)发生术后亚急性疼痛,其中29例(54.7%)在3个月时出现持续性疼痛,而在未出现亚急性疼痛的63例患者中,仅7例(11.1%)在3个月时出现持续性疼痛。36例(32.7%)发生慢性术后疼痛,且随着时间的推移,中重度疼痛的发生率由术后亚急性疼痛患者中的56.6 %(30/53),NRS(4.9±1.2)分,下降至慢性术后疼痛患者中的33.3 %(12/36),NRS(5.2±1.1)分。
术后亚急性疼痛最常见的疼痛部位是腹部(35.8%),其次是胸部(34%)和下肢(20.8 %)。慢性术后疼痛最常见的疼痛部位是胸部(36.1%),其次是下肢(27.8%)和腹部(22.2%)。其中近80%的疼痛均在手术部位出现。术后亚急性和慢性疼痛主要疼痛性质均为钝痛,详见表2。
表2 术后返回ICU患者亚急性和慢性疼痛的强度、部位和性质
2.3 慢性疼痛影响因素分析
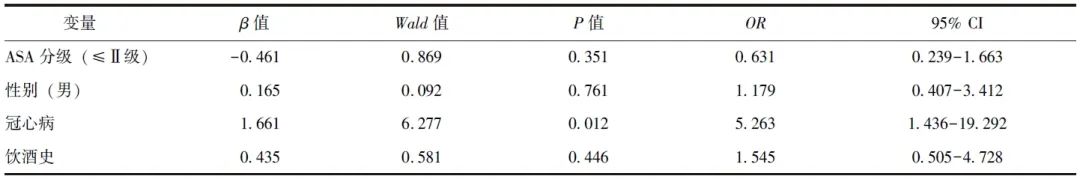
对术后发生疼痛相关影响因素进行分析发现,术后亚急性疼痛患者手术时间更长,饮酒史比例更高,更有可能合并冠心病(P 均<0.05)。慢性术后疼痛患者更有可能合并冠心病(P<0.05)。筛选组间比较时将P<0.15的变量进行多因素Logistic回归分析,包括性别、合并冠心病、饮酒史、ASA分级,结果显示冠心病(OR=5.263,95% CI:1.436~19.292)是术后返回ICU患者慢性疼痛的危险因素,详见表3。
表3 多因素Logistic回归分析术后返回ICU患者发生慢性疼痛的危险因素
3 讨论
3.1 术后亚急性及慢性疼痛发生率及特征
本研究首次探索了术后返回ICU患者的亚急性和慢性疼痛情况,发现术后返回ICU患者中重度亚急性和慢性疼痛发生率分别为56.6%和33.3%,且该人群中重度疼痛发生率高于普通术后人群,介于ICU康复后持续性疼痛的发生率之间。
基于普通人群的调查研究结果显示,约19%的欧洲成人存在中重度疼痛[11],约10.4%~14.3%的英国成人患者存在中重度疼痛[12]。针对ICU康复后持续疼痛的研究表明,康复后3个月、6个月和24个月疼痛发生率分别为49.2%~77%、22%~44%和36%[13-20]。本研究结果提示,术后返回ICU患者疼痛情况与上述研究疼痛轨迹不尽相同,可能受该类人群特征的影响。而54.7%的术后亚急性疼痛患者在术后3个月存在持续性疼痛。
目前关于亚急性疼痛向慢性疼痛的转化机制尚不明确,可能是由多方面因素综合作用的结果。如未控制的急性和亚急性疼痛可能发生外周和中枢敏化。敏化的神经元痛阈降低,反应变得更强烈,神经元结构的重塑使疼痛的持续时间更长。外周神经纤维和中枢神经纤维的膜兴奋性增加、突触可塑性和下行抑制疼痛纤维功能的丧失[7]。
疼痛强度是持续性疼痛临床表现的重要组成部分。本研究结果显示,术后返回ICU患者的术后中重度亚急性疼痛和慢性疼痛NRS平均值分别为4.9±1.2和5.2±1.1。既往研究主要探讨了纳入人群持续性疼痛的平均NRS,如心脏术后3个月NRS为(3.2±1.9)分[21],ICU康复后3个月NRS为2(1,5)分[10]。本研究除纳入人群总体NRS外,还统计中重度疼痛患者的NRS,可用于指导需要干预患者的疼痛治疗效果评价。
本研究结果显示,术后返回ICU患者最常见的术后疼痛部位为胸、腹部和下肢,普通患者最常见的持续性疼痛部位为背、髋、膝和足[22],心脏手术后持续性疼痛的常见部位有腰部、下肢和头颈部[21],ICU患者康复后1年最常见疼痛部位是胸部、下肢[23-24]。本研究与既往研究的异同可能与纳入患者中切口位于胸腹部的心脏、基本外科、妇科手术居多相关,这对手术创伤及ICU治疗参与本类人群持续性疼痛的发生机制方面可能有提示意义。
3.2 慢性疼痛的影响因素
本研究单因素分析结果发现,饮酒史、手术类型、合并冠心病、手术时长与术后返回ICU患者持续性疼痛相关。既往研究与本研究类似,长期过度饮酒有助于术后急性疼痛向慢性疼痛的转变[25],会加重原有的持续性疼痛,出现与乙醇相关的周围神经病变,造成神经损伤[26]。长时程手术可能导致患者一般情况危重或组织损伤增加,这在术后返回ICU患者术后持续性疼痛发生发展中的影响有待进一步研究。
本研究结果提示,合并冠心病是慢性疼痛的危险因素,可能与胸部手术持续性疼痛常见于手术部位有关,这与冠心病患者症状类似,可能会导致部分冠心病患者被认为存在持续性疼痛。在美国常见手术的慢性术后疼痛中,开颅手术后中重度慢性疼痛发生率最高(25%),其次为开胸手术、冠脉旁路移植术、乳腺切除术、膝关节置换术(5%~15%),而椎体减压和脊柱融合、髋关节置换、腹股沟疝切除术等发生率相对较低(2%~6%)[3]。在手术过程中,手术技术(腔镜或开放)、切口部位以及切口类型、医师的经验以及提供相关治疗的医疗中心都与术后持续性疼痛的发生有关, 也有可能与纳入患者中合并冠心病的居多相关。
3.3 慢性疼痛的管理及干预措施
研究表明,慢性疼痛症状可能是危重病和ICU内管理的结果[10]。因此,ICU内的治疗对出院后的疼痛也至关重要。阿片类药物是ICU患者非神经病理性疼痛的首选镇痛药。使用辅助药物,与阿片类药物联合使用,可能会进一步改善镇痛效果,并最大限度地减少不必要的副作用[27]。指南建议,对成人ICU患者进行有创或潜在的疼痛性操作,也可采用超前镇痛治疗和/或非药物干预来减轻疼痛[28]。在各种手术中,区域神经阻滞可能通过不同的机制降低术后持续性疼痛的发生,也在ICU患者的补充镇痛中广泛应用[29]。近年来的研究表明,采用按摩疗法、冷疗法、音乐和声音疗法以及放松疗法等非药物性治疗可减少对药物干预的需要[30]。可以肯定的是,围术期多模式疼痛管理能够改善患者ICU住院期间疼痛体验及其短期和长期预后。
本研究局限性:(1)其中12例患者失访,可能增加数据偏倚风险;(2)本研究为单中心观察性研究,虽然基于研究人群的特殊性,较难开展随机对照研究,但仍有待进一步开展大规模、多中心研究证实。
4 小结
综上,术后返回ICU患者的术后亚急性和慢性疼痛较为常见,疼痛常累及胸腹部及下肢,与饮酒、手术时长、手术类型和合并冠心病相关。其中合并冠心病是术后返回ICU患者慢性疼痛的危险因素。未来应进一步开展人群特征及相关因素的大规模、多中心研究,以明确持续性疼痛发生的机制。
参考文献
[1]Bennett M I, Kaasa S, Barke A, et al. The IASP classification of chronic pain for ICD-11: chronic cancer-related pain[J]. Pain, 2019, 160(1): 38-44.
[2]Macrae W A. Chronic post-surgical pain: 10 years on[J]. Br J Anaesth, 2008, 101(1): 77-86.
[3]Glare P, Aubrey K R, Myles P S. Transition from acute to chronic pain after surgery[J]. Lancet, 2019, 393(10180): 1537-1546.
[4]Richebé P, Capdevila X, Rivat C. Persistent postsurgical pain: pathophysiology and preventative pharmacologic considerations[J]. Anesthesiology, 2018, 129(3): 590-607.
[5]Mi X L, Zou B M, Rashidi P, et al. Effects of patient and surgery characteristics on persistent postoperative pain: a mediation analysis[J]. Clin J Pain, 2021, 37(11): 803-811.
[6]Kemp H I, Laycock H, Costello A, et al. Chronic pain in critical care survivors: a narrative review[J]. Br J Anaesth, 2019, 123(2): e372-e384.
[7]Kyranou M, Puntillo K. The transition from acute to chronic pain: might intensive care unit patients be at risk?[J]. Ann Intensive Care, 2012, 2(1): 36.
[8]Puntillo K A, Max A, Timsit J F, et al. Determinants of procedural pain intensity in the intensive care unit. The Europain® study[J]. Am J Respir Crit Care Med, 2014, 189(1): 39-47.
[9]Mäkinen O J, Bäcklund M E, Liisanantti J, et al. Persistent pain in intensive care survivors: a systematic review[J]. Br J Anaesth, 2020, 125(2): 149-158.
[10]Bourdiol A, Legros V, Vardon-Bounes F, et al. Prevalence and risk factors of significant persistent pain symptoms after critical care illness: a prospective multicentric study[J]. Crit Care, 2023, 27(1): 199.
[11]Breivik H, Collett B, Ventafridda V, et al. Survey of chronic pain in Europe: prevalence, impact on daily life, and treatment[J]. Eur J Pain, 2006, 10(4): 287-333.
[12]Fayaz A, Croft P, Langford R M, et al. Prevalence of chronic pain in the UK: a systematic review and meta-analysis of population studies[J]. BMJ Open, 2016, 6(6): e010364.
[13]Langerud A K, Rustøen T, Brunborg C, et al. Prevalence, location, and characteristics of chronic pain in intensive care survivors[J]. Pain Manag Nurs, 2018, 19(4): 366-376.
[14]Hayhurst C J, Jackson J C, Archer K R, et al. Pain and its long-term interference of daily life after critical illness[J]. Anesth Analg, 2018, 127(3): 690-697.
[15]Carrie C, Guemmar Y, Cottenceau V, et al. Long-term disability after blunt chest trauma: Don't miss chronic neuropathic pain![J]. Injury, 2019, 50(1): 113-118.
[16]Battle C E, Lovett S, Hutchings H. Chronic pain in survivors of critical illness: a retrospective analysis of incidence and risk factors[J]. Crit Care (Fullerton), 2013, 17(3): R101.
[17]Baumbach P, Götz T, Günther A, et al. Somatosensory functions in survivors of critical illness[J]. Crit Care Med, 2017, 45(6): e567-e574.
[18]Boyle M, Murgo M, Adamson H, et al. The effect of chronic pain on health related quality of life amongst intensive care survivors[J]. Aust Crit Care, 2004, 17(3): 104-106.
[19]Jeitziner M M, Hamers J P H, Bürgin R, et al. Long-term consequences of pain, anxiety and agitation for critically ill older patients after an intensive care unit stay[J]. J Clin Nurs, 2015, 24(17/18): 2419-2428.
[20]Archer K R, Abraham C M, Song Y N, et al. Cognitive-behavioral determinants of pain and disability two years after traumatic injury: a cross-pal survey study[J]. J Trauma Acute Care Surg, 2012, 72(2): 473-479.
[21]Xiao M Z X, Khan J S, Dana E, et al. Prevalence and risk factors for chronic postsurgical pain after cardiac surgery: a single-center prospective cohort study[J]. Anesthesiology, 2023, 139(3): 309-320.
[22]Yong R J, Mullins P M, Bhattacharyya N. Prevalence of chronic pain among adults in the United States[J]. Pain, 2022, 163(2): e328-e332.
[23]Devine H, Quasim T, McPeake J, et al. Chronic pain in intensive care unit survivors: incidence, characteristics and side-effects up to one-year post-discharge[J]. J Rehabil Med, 2019, 51(6): 451-455.
[24]Koster-Brouwer M E, Rijsdijk M, van Os W K M, et al. Occurrence and Risk Factors of Chronic Pain After Critical Illness[J]. Critical care medicine, 2020, 48(5): 680-687.
[25]赵珊珊, 张宗旺. 饮酒对疼痛的影响及其机制研究进展[J]. 国际麻醉学与复苏杂志, 2020, 41(9): 915-919.
[26]Egli M, Koob G F, Edwards S. Alcohol dependence as a chronic pain disorder[J]. Neurosci Biobehav Rev, 2012, 36(10): 2179-2192.
[27]Pota V, Coppolino F, Barbarisi A, et al. Pain in intensive care: a narrative review[J]. Pain Ther, 2022, 11(2): 359-367.
[28]Barr J, Fraser G L, Puntillo K, et al. Clinical practice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit[J]. Crit Care Med, 2013, 41(1): 263-306.
[29]Ehieli E, Yalamuri S, Brudney C S, et al. Analgesia in the surgical intensive care unit[J]. Postgrad Med J, 2017, 93(1095): 38-45.
[30]Nordness M F, Hayhurst C J, Pandharipande P. Current perspectives on the assessment and management of pain in the intensive care unit[J]. J Pain Res, 2021, 14: 1733-1744.


