Cancer Res:复旦大学王红霞/丁琛/朱玮系统解析乳腺癌血清外泌体图谱,并发现治疗新靶点
时间:2024-07-28 21:00:28 热度:37.1℃ 作者:网络
细胞外囊泡(EVs)分析是一种很有前景的无创乳腺癌(BC)检测、预后和治疗监测的液体活检方法。为了实现这一策略的潜力,需要全面了解来自人类样本的BC特异性EVs的特征和蛋白质组学组成。
2024年6月20日,复旦大学王红霞、丁琛及朱玮共同通讯在Cancer Research在线发表题为“Proteomic Profiling of Serum Extracellular Vesicles Identifies Diagnostic Signatures and Therapeutic Targets in Breast Cancer”的研究论文,该研究阐明了BC患者血清EVs的蛋白质组改变,以指导改进诊断、监测和治疗策略的发展。
研究应用了一种基于质谱的、数据独立采集(DIA)的蛋白质组学方法来表征一个发现队列中来自BC患者(n=126)和健康供者(HDs, n=70)的人血清EVs,并在五个独立队列中验证了研究结果。检测EV蛋白组可以构建特异性EV蛋白分类器,用于诊断BC和区分转移性疾病患者。值得注意的是,TALDO1被发现是BC远处转移的EV生物标志物。体外和体内分析证实了TALDO1在刺激BC侵袭和转移中的作用。最后,通过高通量分子对接和虚拟筛选由271,380个小分子组成的文库,鉴定出一种有效的TALDO1变构抑制剂AO-022,可抑制BC的体外迁移和体内肿瘤进展。

乳腺癌(BC)是全球最常见的癌症之一,占女性癌症的 30%。远处转移是 BC 相关死亡的主要原因。BC患者转移状态的早期发现和动态评估对治疗的治疗和癌症反应演变的纵向分析具有重要价值。为了实现这一目标,与传统的肿瘤组织活检相比,利用在患者血液中检测到的分子分类器(如细胞外囊泡 (EV))进行的液体活检具有最小的侵入性、更少的并发症和更高的纵向监测能力。EV 的大小为 30-200 nm,携带一组有限的核酸、脂质和蛋白,这些核酸、脂质和蛋白有助于正常生理和病理学中的细胞间通讯。
EV 的功能重要性已在包括 BC 在内的多种人类癌症中进行了深入研究。越来越多的证据表明,EV 会从癌细胞中积极释放,并促进癌症生长和转移。值得注意的是,EV 膜包封的特征促进了其结构完整性,并且位于 EV 内的货物比其他血清学蛋白更稳定,这是基于循环蛋白酶和其他酶对降解的保护。考虑到 EV 有助于检索,并且它们在血清中相对普遍存在和丰度,EV 作为一种有前途的非侵入性液体活检方法,可以为 BC 检测、预后和治疗监测的下游分析提供充足的材料。EV 蛋白质组作为 BC 检测和分层的信息读数具有独特的优势。但缺乏对 BC 特定 EVs 特性的全面理解对人类样本独特蛋白质组学信息的组成。
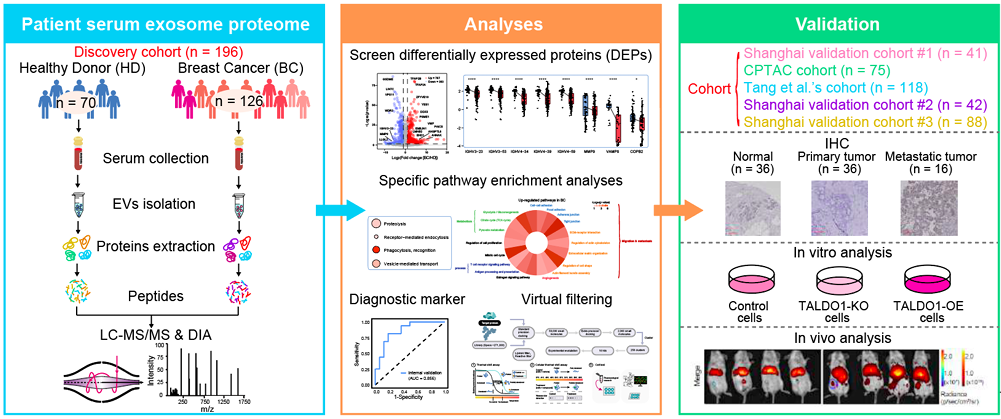
图形摘要(图源自Cancer Research)
研究收集了一个发现队列和五个验证队列,共涉及 560 个样本。发现队列设计为一项例对照研究,涉及 196 个样本,包括 70 名健康供体(HD)和 126 名乳腺癌(BC)。此外,研究根据五个独立队列进行了五步验证。研究应用基于质量光谱法的数据非依赖性采集(DIA)定量方法来表征来自发现队列中名 BC 和 HD 患者的人类血清 EV 的蛋白质组学分析。通过检查 EV蛋白质组,研究构建了特异性 EV 蛋白标识符,可作为液体活检工具,用于诊断 BC 以及评估淋巴淋巴结 (LN) 转移。综合组织-血清 EV 蛋白质组学方法将 TALDO1 确定为一种新型 EV 生物标志物,与BC 远处转移的不良预后相关。最后,通过高通量分子对接和对271,380个小分子组成的文库进行次虚拟筛选,鉴定出一种有效的TALDO1变构抑制剂AO-022,该抑制剂可抑制体外BC迁移和体内肿瘤进展。研究可为准确诊断和监测BC进展提供参考价值,为EVs包装新分子的鉴定为未来BC的靶向治疗提供机会。
免责声明:iNature专注于最新的研究进展。本文仅作信息交流之目的,文中观点不代表iNature立场,亦不代表iNature支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
参考消息:
https://aacrjournals.org/cancerres/article/doi/10.1158/0008-5472.CAN-23-3998/746027/Proteomic-Profiling-of-Serum-Extracellular


