JCI:东北大学盛韧等团队提出新型肿瘤细胞周期调控机制与靶向治疗方案
时间:2024-07-28 21:00:25 热度:37.1℃ 作者:网络
癌症中的细胞周期调节在很大程度上是不正常的。对异常细胞周期的分子理解和治疗靶向具有重大意义。
2024年7月4日,东北大学盛韧、丁辰及中国科学院长春应用化学研究所王士学共同通讯在The Journal Of Clinical Investigation 在线发表题为“CDKL3 is a targetable regulator of cell cycle progression in cancers”的研究论文,该研究发现了一种未被充分重视的丝氨酸/苏氨酸激酶CDKL3(细胞周期依赖性激酶样3),它对癌症中快速的细胞周期进展和细胞生长起着至关重要的作用。
从机制上讲,CDKL3定位在细胞核中并与特定的细胞周期蛋白结合,直接磷酸化视网膜母细胞瘤(Rb)以退出静止状态。同时,CDKL3通过在T172上直接磷酸化来阻止CDK4的泛素蛋白酶体降解,以维持G1期进展。CDKL3在癌症中的重要作用在体外和体内均得到了证实。还设计、合成并表征了首创的CDKL3特异性抑制剂HZ1。HZ1在泛癌症治疗中表现出比CDK4/6(细胞周期依赖性激酶4/6)抑制剂更强的效力,因为它能引起细胞周期停滞,并克服后者的获得性耐药性。特别是,CDKL3在结肠癌中具有重要的临床意义,小鼠和患者衍生的癌症模型证明了HZ1的有效性。总之,这项研究提出了一种癌症细胞周期调控的综合范例,并表明CDKL3靶向是一种可行的癌症治疗方法。

细胞周期由多个模块和机制组成,以精确的方式调节细胞分裂。一个完整的细胞周期依次由G1、S、G2和M期组成。细胞周期的进展主要由各个阶段的细胞周期蛋白和细胞周期依赖性激酶(CDK)控制。例如,已知CDK4/6-细胞周期蛋白D对维持G1期前进。在G1/S期检查点,CDK1/2-细胞周期蛋白E/A的组合接管了G1到S转换的责任。在这两个过程中,CDK对Rb蛋白的磷酸化是必不可少的。磷酸化的Rb(即S807/S811)可以与转录因子E2F分离,导致随后阶段所需的多个细胞周期相关基因的表达。
除了主动循环之外,细胞还可以退出细胞周期并处于称为G0期的静止/静止状态。处于这种状态的细胞通常不分裂也不生长。G0期的进入和退出的调控机制尚不清楚。早期文献表明,CDK3-细胞周期蛋白C通过磷酸化Rb来支持G0到G1期的转变。然而,大多数实验室小鼠的CDK3都存在天然的功能丧失突变,没有表型缺陷。因此,CDK3在G0期退出中的生物学重要性被这种现象所削弱。尽管近年来有报道称有新的因子可以调节这种转变,但对这一过程的理解仍然严重不足。
癌症中的细胞周期经常失调。正常细胞有明确的细胞周期进入和退出时间表。然而,各种类型的(表观)遗传变化使癌细胞能够绕过静止期。因此,在癌症中,加速和不受控制的细胞周期随处可见,这有利于无限的有丝分裂增殖。靶向细胞周期进程已被证明在癌症治疗中是有效的。由于CDK在细胞周期调控中发挥的核心作用以及其酶促特性,目前已有多种针对CDK的小分子抑制剂被设计并投入临床试验或已获准用于癌症治疗。然而,临床反馈指出这些抑制剂存在获得性耐药性的挑战。因此,发现新的靶点来克服这一问题具有更大的必要性和价值。
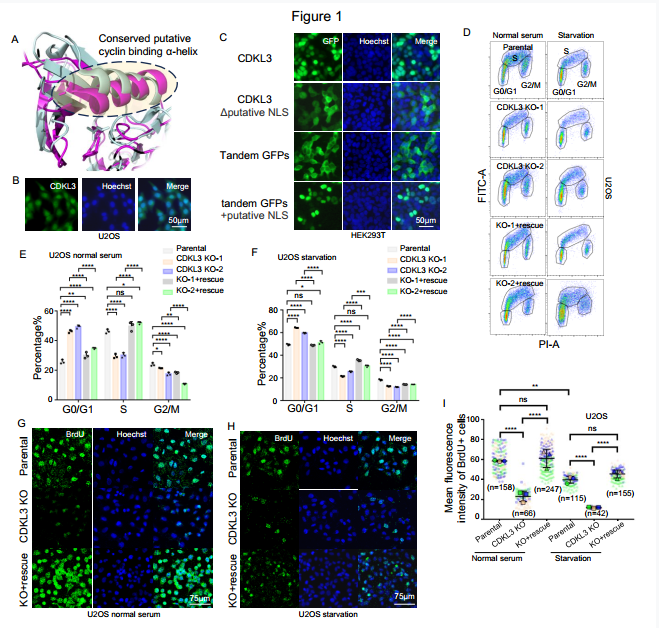
CDKL3缺失导致癌症细胞周期停滞(图源自The Journal Of Clinical Investigation )
CDKL3属于细胞周期依赖性激酶样(CDKL)激酶亚家族,是CMGCSer/Thr蛋白激酶超家族的一部分。CDKL激酶共享CDK激酶结构域上保守的α-螺旋作为假定的细胞周期蛋白结合位点。但CDKL是否能够结合细胞周期蛋白或通过细胞周期蛋白发挥作用尚不清楚。事实上,CDKL家族在功能和机制方面总体上尚未得到充分探索。CDKL5已被证明与神经系统疾病有关,而据报道CDKL1可调节纤毛形成。尽管据报道CDKL3与癌症进展有关,但其机制需要进一步审查和严格的证据。
在这里,报道CDKL3直接促进癌症中的细胞周期进展。分子上存在两条平行的调控路径。首先,CDKL3与细胞周期蛋白A2偶联,直接导致Rb磷酸化和G0到G1的转变。CDKL3的消融会导致癌症细胞周期退出和生长迟缓。此外,CDKL3可以在细胞周期蛋白A2的帮助下磷酸化T172上的CDK4。这导致CDK4避免经历泛素-蛋白酶体依赖性降解,从而维持G1期进展。E3泛素连接酶(如Trim28)在没有T172磷酸化的情况下导致CDK4泛素化。
此外,合理设计和表征了专门针对CDKL3的小分子抑制剂HZ1。HZ1在纳摩尔范围内表现出强大的IC50肿瘤抑制作用,并有可能克服CDK4/6抑制剂的耐药性,并在实验动物和患者来源的样本中表现出令人满意的肿瘤清除率。总之,发现了一系列关于CDKL3在细胞周期调控中关键作用的机制发现,并揭示了CDKL亚家族激酶的细胞周期蛋白依赖性功能。除了在基础生物医学研究方面的价值之外,这项工作还通过针对CDKL3介导的癌细胞周期进展提出并提出了一种替代的癌症治疗方法。
参考消息:
https://www.jci.org/articles/view/178428


