Biomaterials:西北工业大学李林等团队合作制备线粒体靶向光敏剂增强肿瘤特异性光动力治疗效果
时间:2024-11-02 23:01:03 热度:37.1℃ 作者:网络
肿瘤消融临床前细胞器靶向光疗已有效实现肿瘤光消融,实现了癌症治疗中的再生生物医学应用。然而,设计具有精确肿瘤细胞器靶向的光疗药物仍具有挑战性。
2024年10月25日,西北工业大学/厦门大学李林、西北工业大学周巍和Chen Xi共同通讯在Biomaterials 上在线发表题为“Albumins constrainting the conformation of mitochondria-targeted photosensitizers for tumor-specific photodynamic therapy”的研究论文。该研究报道了一种用于肿瘤特异性光动力治疗的线粒体靶向光敏剂白蛋白纳米颗粒(PSs@BSAs)。
X射线晶体学阐明了PSs@BSAs的两阶段组装机制。飞秒瞬态吸收光谱和量子力学计算揭示了激发态构象动力学的影响。PSs@BSAs可以有效抑制线粒体活性,通过光动力学效应进一步破坏肿瘤血管生成,触发代谢和氧化应激失衡,增强实体瘤和抗肿瘤转移的光消融疗效。该研究充分阐明了化学、物理和生物界面的跨学科问题,为设计生物医学应用的细胞器靶向肿瘤特异性光敏剂开辟了新方向。

癌症对现代医学构成了重大挑战。光疗具有独特的优势,如无创性、时间和空间可控激活、降低长期发病率以及对放射治疗或化疗药物没有交叉耐药性等。当前已批准光疗作为临床一线癌症疗法,在某些情况下比放疗、化疗和手术更安全。过去几十年中,基于光敏剂(PS)的治疗药物在癌症治疗方面取得了重大进展,但其治疗效果仍远低于预期。由于对光敏药物的超快光化学过程机制以及光敏药物与循环系统、器官、肿瘤和细胞之间的相互作用缺乏深入了解,此类治疗诊断系统面临制备过程复杂、治疗效果较差、成分复杂、光活性多变以及体内药物摄取效率和安全性低等问题,限制了其广泛临床应用。
蛋白质与光敏剂的结合以及对其激发能量转移的调节,使得光和生物之间产生了独特的相互作用。白蛋白是一种无免疫原性的血清固有成分,Abraxane成功实现临床应用,证明了其在药物递送、生物医学成像和治疗方面的应用前景。受天然细菌光系统中复杂光采集系统的启发,如色素蛋白复合物采集太阳光并将其转化为化学能,作者提出了一种牛血清白蛋白(BSA)约束线粒体靶向光敏剂(吡啶硫酮)纳米颗粒(PSs@BSAs),该纳米颗粒基于两阶段组装(TASE)策略制备而成,无需冗余载体的辅助,可在人宫颈癌异种移植物中实现光动力治疗(PDT)。
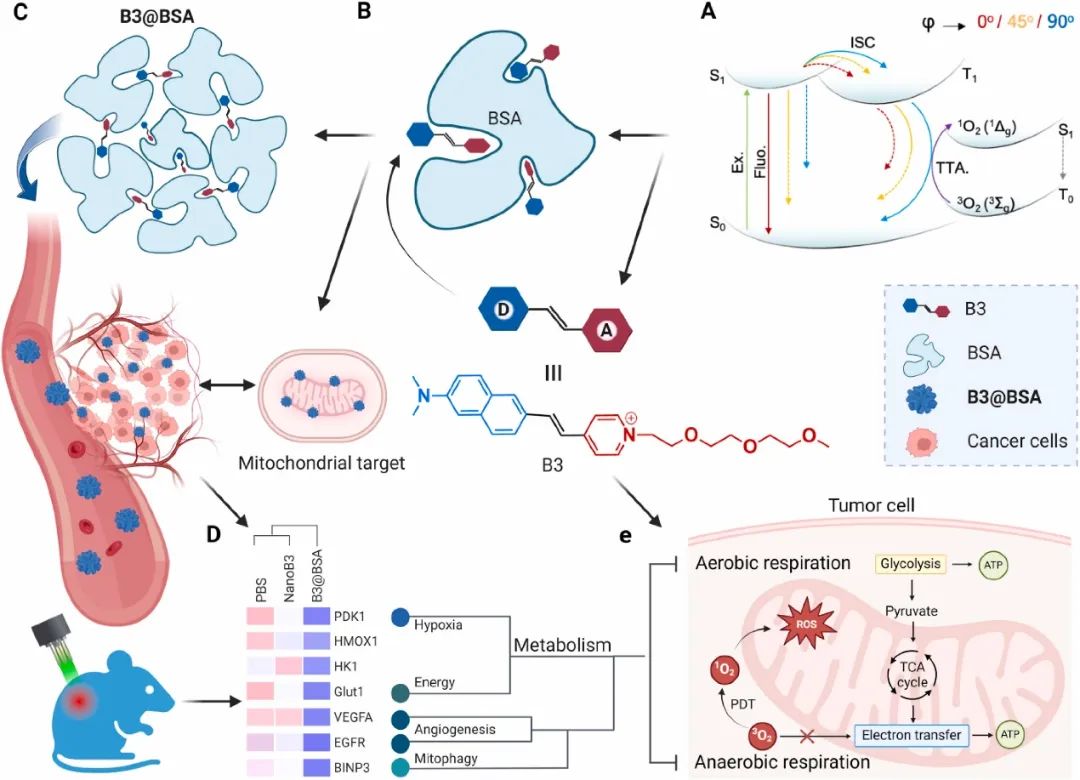
图1 PSs@BSAs用于肿瘤特异性线粒体靶向光疗示意图(摘自Biomaterials )
PSs@BSAs能够特异性靶向肿瘤细胞,且吡啶硫酮的正电荷会驱动其在线粒体的精确积累,改善患者体内的生物分布和药代动力学,最大限度地减少副作用,显著降低治疗阈值剂量,最终提高癌症光疗指数。X射线晶体学揭示了具有五种不同构象的PSs结合位点的新结构。飞秒瞬态吸收光谱和量子力学计算揭示了激发态构象动力学的机制。PSs@BSAs处理的宫颈癌组织的全基因组核糖核酸(RNA)谱表明,实体肿瘤的光消融与肿瘤血管生成、氧化应激和线粒体代谢(包括有氧糖酵解和氧化磷酸化)的破坏有关。两阶段组装策略加深了对功能特异性细胞器-药物相互作用的理解,并通过光学、化学、物理、生物学和医学之间的相互作用,具备创新癌症治疗诊断学的巨大潜力,加速了临床转化。
参考消息:
https://www.sciencedirect.com/science/article/pii/S0142961224004484?via%3Dihub


